
| A. | 氯气可以和澄清石灰水反应制造漂白粉 | |
| B. | 金属钠可以用来冶炼某些金属 | |
| C. | 石灰石用于工业炼铁和玻璃制造 | |
| D. | 二氧化硅可以用于制作光学镜片,也可以制造光导纤维 |
分析 A.工业上常用石灰乳和氯气反应制漂白粉;
B.金属钠性质活泼,具有强的还原性;
C.炼铁是将原料(铁矿石、焦炭、石灰石)通入高炉中,在高炉中发生复杂反应,生成铁的单质;普通玻璃的原料有:砂子,石灰石和纯碱;
D.二氧化硅具有良好的光学特性;
解答 解:A.工业上常用石灰乳和氯气反应制漂白粉,故A错误;
B.金属钠性质活泼,具有强的还原性,可以用来冶炼金属如:钛等,故B正确;
C.炼铁材料为铁矿石、焦炭、石灰石,普通玻璃的原料有:砂子,石灰石和纯碱,所以石灰石是炼铁和制玻璃的原料之一,故C正确;
D.二氧化硅具有良好的光学特性,可以用于制作光学镜片,也可以制造光导纤维,故D正确;
故选:A.
点评 本题考查了元素化合物知识,侧重考查物质的用途,明确物质的性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题

| 物 质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 浓硝酸 | - | 83 | 1.4 | 易溶于水 |
| 浓硫酸 | - | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④③⑦⑧⑥ | B. | ②③⑦⑤⑥ | C. | ①③⑧⑥⑦ | D. | ②⑥③⑦⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=1的溶液中:SO32-、Cl-、NO3-、Na+ | |
| B. | 在能使酚酞变红的溶液中:Na+、Cl-、NO3-、K+ | |
| C. | 在1 mol•L-1的NaAlO2溶液中:K+、Ba2+、SO42-、OH- | |
| D. | 在1 mol•L-1的AlCl3溶液中:NH4+、Ag+、Na+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
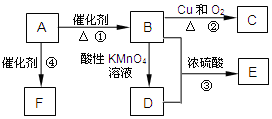 有机物A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平.C在一定条件下也会生成D,D能使石蕊溶液变红;E是具有果香味的有机物,F是一种高分子化合物,可制成多种包装材料.
有机物A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平.C在一定条件下也会生成D,D能使石蕊溶液变红;E是具有果香味的有机物,F是一种高分子化合物,可制成多种包装材料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下A、B两气体的密度之比为a:b | |
| B. | 同质量气体A与B的分子数之比为b:a | |
| C. | 两种气体A与B的相对分子质量之比为b:a | |
| D. | 相同状况下同体积A、B质量之比为a:b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此时水的转化率为71.4% | |
| B. | 此时CO2的体积分数为20.4% | |
| C. | 若再向容器内通入5mol H2O,则达到新平衡时,H2O的转化率升高 | |
| D. | 若从容器内移走5mol H2O,则达到新平衡时,CO的转化率升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
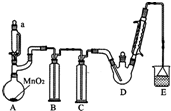 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com