
【题目】某化工厂用软锰矿(含MnO2及少量Al2O3)和闪锌矿(含ZnS及少量FeS)联合生产Zn、MnO2 , 其部分生产流程如下: 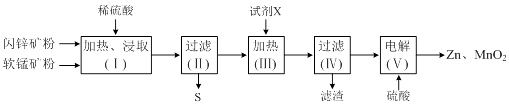
已知:过滤(Ⅱ)所得滤液是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液.相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0molL﹣1计算)如下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Mn(OH)2 |
开始沉淀时的pH | 2.7 | 4.0 | 6.4 | 7.7 |
完全沉淀时的pH | 3.7 | 5.2 | 8.0 | 10.4 |
(1)加热、浸取时所加矿石均需粉碎,其目的是 .
(2)写出FeS和MnO2和稀硫酸反应的离子方程式: .
(3)试剂X的作用是调节溶液的pH以生成Fe(OH)3、Al(OH)3 . pH调节的范围是 , 试剂X可以选用(填选项字母).
A.MnCO3 B.Na2CO3 C.Zn2(OH)2CO3 D.NH3H2O
(4)电解(Ⅴ)中阳极的电极反应式为 .
(5)Zn和MnO2是制作电池的原料.某锌﹣锰碱性电池以KOH溶液为电解质溶液,其电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s).该电池的正极的电极反应式为 .
【答案】
(1)加快反应(浸取)速率
(2)2FeS+3MnO2+12H+=2Fe3++2S↓+3Mn2++6H2O
(3)5.2~6.4;AC
(4)Mn2++2H2O﹣2e﹣=MnO2+4H+
(5)2MnO2(s)+H2O(l)+2e﹣=Mn2O3(s)+2OH﹣
【解析】解:(1)加热、浸取时所加矿石均需粉碎,其目的是:加快反应(浸取)速率,故答案:加快反应(浸取)速率;(2)FeS和MnO2和稀硫酸反应的离子方程式:2FeS+3MnO2+12H+=2Fe3++2S↓+3Mn2++6H2O,
所以答案是:2FeS+3MnO2+12H+=2Fe3++2S↓+3Mn2++6H2O;(3)试剂X的作用是调节溶液的pH以生成Fe(OH)3、Al(OH)3 . 结合图表数据分析,选择溶液PH能使铁离子、铝离子全部沉淀,锰离子不沉淀,图表中离子开始菜单和菜单完全的溶液PH得到,pH调节的范围是:5.2~6.4,加入试剂不能引入新的杂质,试剂X可以选择,
A.MnCO3 和酸反应且不引入新的杂质,故A正确;
B.Na2CO3 和酸反应但会引入新的杂质钠离子,故B错误;
C.Zn2(OH)2CO3 和酸反应,不引入新的杂质,故C正确;
D.NH3H2O和酸反应,但会引入新的杂质铵根离子,故D错误;
所以答案是:5.2~6.4;AC;(4)电解ZnSO4、MnSO4溶液,根据溶液中离子的放电顺序,阳极反应:Mn2+﹣2e﹣+2H2O═MnO2+4H+ , Fe作阴极,阴极反应:Zn2++2e﹣═Zn,
所以答案是:Mn2++2H2O﹣2e﹣=MnO2+4H+;(5)根据电极反应式Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s),可知电池工作时,负极材料是Zn,发生氧化反应生成Zn(OH)2 , 电极反应式为Zn﹣2e﹣+2OH﹣=Zn(OH)2 , 正极材料为MnO2 , 发生还原反应,电极反应式为2MnO2(s)+H2O(l)+2e﹣=Mn2O3(s)+2OH﹣ , 电子从负极沿导线流向正极,
所以答案是:2MnO2(s)+H2O(l)+2e﹣=Mn2O3(s)+2OH﹣ .


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.含有共价键的化合物一定是共价化合物
B.分子中只有共价键的化合物一定是共价化合物
C.由共价键形成的分子一定是共价化合物分子
D.只有非金属原子间才能形成共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜跟1mol/L的硝酸溶液反应,若C(NO3-)下降了0.2mol/L,则C(H+)下降
A. 0.2mol/L B. 0.8mol/L C. 0.6mol/L D. 0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在H2SO4、K2SO4、Al2(SO4)3和明矾[KAl(SO4)212H2O]的混合溶液中,H+的浓度为0.2mol/L,SO42﹣的浓度为0.5mol/L,当加入等体积0.6mol/L KOH溶液时,生成的沉淀恰好完全溶解.则反应后溶液中K+的浓度约为( )
A.0.225mol/L
B.0.25mol/L
C.0.45mol/L
D.0.55mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁是一种活泼的金属,可以在CO2中燃烧生成MgO和C,海水中镁含量很大,世界上生产的镁60%来自海水.海水提镁,需要在海水中加碱,然后沉淀分离后转化为氯化镁,最后电解得到金属镁.试根据你已有的知识,回答下列问题:
(1)请用流程图式表示工业上用海水提炼镁的主要工序 .
(2)若金属镁的提取都是利用电解氯化镁来进行的.请写出电解氯化镁的化学方程式 , 在电解过程中还原剂是 , 氧化产物是 .
(3)若用电解制得的镁来制镁粉,可将镁加热变成蒸气,然后冷却得到镁粉,这个过程能在空气中进行吗?原因是什么? , 现有气体:二氧化碳、氢气、氩气、氮气、氧气,可以选择用于冷却镁粉的气体有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化的说法正确的是()
A. 蜡烛受热熔化和蜡烛燃烧都是物理变化 B. 海水“晒盐”和海水“制纯碱”都是物理变化
C. 葡萄光合作用和葡萄酿酒都是化学变化 D. 工业上制取氧气和实验室制取氧气都是化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铜是生活中两种常见的金属材料,某同学查阅资料得知铁主要是由铁矿石经热还原的方法冶炼的,常见的铁矿石有磁铁矿、赤铁矿、黄铁矿(主要成分为FeS2)等.
(1)赤铁矿的主要成分为(填化学式),工业上用赤铁矿冶炼铁的化学反应方程式为;
(2)从矿物资料查得,一定条件下自然界存在如下反应: 14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4;
该反应中氧化剂是(填化学式),当有5molFeS2发生反应时,电子转移数为;
(3)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,用FeCl3溶液作“腐蚀液”,请写出刻制过程的离子方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com