
【题目】Cl2O为国际公认的高效安全灭菌消毒剂之一,实验室可利用氯气和空气(氯气与空气体积比为1∶3,空气不参与反应)的混合气与含水8%的碳酸钠反应制备,并用水吸收Cl2O制备次氯酸溶液,所用实验装置和Cl2O的性质如下:

颜色 | 棕黄色 |
状态 | 气体 |
气味 | 强刺激性 |
熔点 | -116 ℃ |
沸点 | 3.8 ℃ |
水溶性 | 极易溶于水,与水反应生成次氯酸 |
热稳定性 | 42 ℃以上分解为Cl2和O2 |
(1)仪器a的名称为________,所盛放的药品是________。
(2)写出装置A中发生反应的离子方程式:_______________。
(3)装置C的主要作用是___________。
(4)装置D、E中都用到多孔球泡,其作用是____________。
(5)写出装置D中Cl2与过量碳酸钠反应生成Cl2O的化学方程式:________。
(6)装置E采用棕色圆底烧瓶的原因是____________。
(7)制备Cl2O装置中存在缺陷,请提出改进措施:___________。
【答案】球形干燥管 碱石灰 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 控制氯气和空气的体积比 增大反应物接触面积,使反应充分进行 2Cl2+2Na2CO3+H2O=2NaCl+Cl2O+2NaHCO3 次氯酸光照易分解 将装置D放在冷水浴中,以控制三颈烧瓶内的温度不超过42℃
Mn2++Cl2↑+2H2O 控制氯气和空气的体积比 增大反应物接触面积,使反应充分进行 2Cl2+2Na2CO3+H2O=2NaCl+Cl2O+2NaHCO3 次氯酸光照易分解 将装置D放在冷水浴中,以控制三颈烧瓶内的温度不超过42℃
【解析】
根据实验原理及装置分析装置的作用及反应离子方程式;根据装置特点分析装置的缺陷并提出改进措施。
(1)仪器a的名称为球形干燥管,盛有碱石灰吸收尾气,防止污染空气。答案为:球形干燥管 、碱石灰;
(2)实验室用浓盐酸与二氧化锰利用装置A制备氯气,离子方程式为:MnO2+4H++2C1-![]() Mn2++Cl2↑+2H2O答案为:MnO2+4H++2C1-
Mn2++Cl2↑+2H2O答案为:MnO2+4H++2C1-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(3)C中盛有浓硫酸便于空气和氯气混合均匀,同时控制氯气和空气的体积比,有利于氯气的反应。答案为:控制氯气和空气的体积比;
(4)装置D、E 中都用到多孔球泡,能增大反应物的接触面积,使反应充分进行。答案为:增大接触面积,使反应充分进行;
(5)氯气与空气体积比为1∶3的混合气体与含水8%的碳酸钠在装置D中发生氧化还原反应生成Cl2O,反应的方程式为:2Cl2+ 2Na2CO3+H2O=2NaCl+Cl2O+2NaHCO3答案为:2Cl2+ 2Na2CO3+H2O=2NaCl+Cl2O+2NaHCO3;
(6)装置E中所得溶液呈黄绿色,要想证明是D中的氯气过量进入E中,只要证明E中含有Cl- 即可,可设计实验如下:取样,滴加硝酸酸化的硝酸银溶液,若有白色沉淀生成,则说明是氯气过量所致 。答案为:取样,滴加硝酸酸化的硝酸银溶液,若有白色沉淀生成,则说明是氯气过量所致;
(7)Cl2O在42℃以上,分解为Cl2和O2,因此装置D中的温度不能过高,所以将装置D放在冰水浴中,以控制三颈烧瓶内的温度不超过42℃。答案为:将装置D放在冰水浴中,以控制三颈烧瓶内的温度不超过42℃。


科目:高中化学 来源: 题型:
【题目】25℃时,向 20 mL 0.1 mol/L NaOH 溶液中逐滴加入 0.1 mol/L 醋酸溶液,滴定曲线如图所示。下列说法正确的是
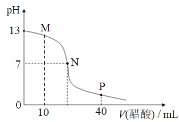
A.该NaOH 溶液中水电离出的 c(OH-)=1×10-12 mol/L
B.M 点时,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.P 点时,c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.N 点对应的横坐标是 20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸、盐酸和碳酸钠是生活中常见的物质。
(1)碳酸钠水溶液显碱性的原因是(用离子方程式表示)_____。(2 分)
(2)25 ℃时,浓度均为 0.1 mol·L-1 的盐酸和醋酸溶液,下列说法正确是_____。
a.两溶液的 pH 相同
b.两溶液的导电能力相同
c.两溶液中由水电离出的 c(OH-)相同
d.中和等物质的量的NaOH,消耗两溶液的体积相同
(3)25 ℃时, pH 均等于 4 的醋酸溶液和氯化铵溶液,醋酸溶液中水电离出的H+浓度与氯化铵溶液中水电离出的H+浓度之比是_____。
(4)醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H-,下列叙述不正确的是_____。
CH3COO-+H-,下列叙述不正确的是_____。
a. CH3COOH 溶液中离子浓度关系满足:c(H+)=c(OH-)+c(CH3COO-)
b. 0.1 mol·L-1的CH3COOH溶液加水稀释,溶液中 c(OHˉ)减小
c. CH3COOH 溶液中加入少量 CH3COONa 固体,平衡逆向移动
d. 常温下,pH=2 的 CH3COOH 溶液与 pH=12 的 NaOH 溶液等体积混合后溶液的 pH>7
e.室温下 pH=3 的醋酸溶液加水稀释,溶液中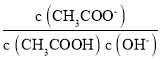 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①H2(g)+![]() O2(g)=H2O(g) ΔH1=akJ·mol1
O2(g)=H2O(g) ΔH1=akJ·mol1
②2H2(g)+O2(g)=2H2O(g) ΔH2=bkJ·mol1
③H2(g)+![]() O2(g)=H2O(l) ΔH3=ckJ·mol1
O2(g)=H2O(l) ΔH3=ckJ·mol1
④2H2(g)+O2(g)=2H2O(l) ΔH4=d kJ·mol1
下列关系式中正确的是
A.a<c<0B.b>d>0C.2a=b<0D.2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如图所示:

(1)A中制取Cl2的反应的化学方程式是_________________________。
(2)B装置的作用:①______;②______;③______。
(3)D装置中的石棉上吸附着潮湿的KI,其作用是________________。
(4)E装置的作用是_____(填序号)。
A.收集气体 B.吸收氯气 C.吸收氯化氢
(5)E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法是______________。
(6)将1 mol CH4与Cl2发生取代反应,测得4种有机取代产物的物质的量相等,则消耗的氯气的物质的量是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2甲烷化是一种实现CO2资源化利用的有效途径。
Ⅰ.热化学转化
CO2甲烷化过程发生反应:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)ΔH
CH4(g)+2H2O(g)ΔH
(1)每生成1mol CH4(g),放热165 kJ,则ΔH=______。
(2)反应的平衡常数的表达式:K=______。温度升高,K______(填“增大”或“减小”)。
(3)其他条件不变时,一段时间内,压强对CO2的转化率及CH4的选择性的影响如下图。

注:选择性=转化为目标产物的原料量÷原料总的转化量
CO2甲烷化反应选择0.1MPa而不选择更高压强的原因是______。
Ⅱ.电化学转化
多晶Cu可高效催化CO2甲烷化,电解CO2制备CH4的原理示意图如下。电解过程中温度控制在10℃左右,持续通入CO2。阴、阳极室的KHCO3溶液的浓度基本保持不变。

(4)多晶Cu作______(填“阴”或“阳”)极。
(5)结合电极反应式,说明阴极室KHCO3溶液浓度基本不变的原因:______。
(6)上述电解过程中采取了______措施(写2条即可)使CO2优先于H+放电。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、氟、硅、铜等元素的化合物广泛存在于自然界,回答下列问题:
(1)基态氟原子核外电子的电子云形状有_____种;氟原子的价电子排布式为___。
(2)NF3是微电子工业中优良的等离子刻蚀气体,NF3分子的空间构型为______;写出与N2互为等电子体的一种离子的化学式_______。
(3)已知金刚石中的C-C键键长为154.45pm,C60中C-C键键长为145~140pm,而金刚石的熔点远远高于C60,其理由是________。
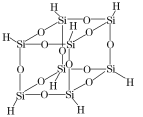
(4)氢基倍半硅氧烷的分子结构如图所示,该分子的分子式为______,Si原子采用_______杂化。
(5)Cu的某种晶体晶胞为面心立方结构,晶胞边长为acm,原子的半径为rcm。该晶体中铜原子的堆积方式为_______(填“A1”“A2”或“A3”),该晶体的密度为______g/cm3(用含a和NA的代数式表示),该晶体中铜原子的空间利用率为______(用含a和r的代数式表达)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别用一个化学方程式解释下列问题。
(1)甲烷与氯气的混合物在漫射光下—段时间,出现白雾:__________________。
(2)溴水中通入乙烯,溴水颜色退去:_________________________。
(3)工业上通过乙烯水化获得乙醇:______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com