
X、Y、Z、W有右图所示的转化关系,已知焓变:
ΔH=ΔH1+ΔH2,则X、Y可能是
①C、CO ②Na2CO3、NaHCO3 ③AlCl3、Al(OH)3 ④FeBr2、FeBr3
A.①②③④ B.①③ C.②④ D.①②③

科目:高中化学 来源: 题型:
下列关于电解质溶液的叙述正确的是( )
A.常温下,同浓度的Na2CO3与NaHCO3溶液相比,Na2CO3溶液的pH大
B.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH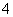 )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
C.中和pH与体积均相同的盐酸和醋酸,消耗NaOH的物质的量相同
D.将pH =4的盐酸稀释后,溶液中所有离子的浓度均降低
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25%氨水的密度为0.91克/厘米3,5%氨水的密度为0.98克/厘米3,若将
上述两溶液等体积混合,所得氨水溶液的质量分数是
A.等于15% B.大于15% C.小于15% D.无法估算
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.热化学方程式中,如果没有注明温度和压强,则表示反应热是在标准状况下测得的数据
B.升高温度或加入催化剂,可以改变化学反应的反应热
C.据能量守恒定律,反应物的总能量一定等于生成物的总能量
D.物质发生化学变化一定伴随着能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
将V1 mL 1.00 mol·L-1HCl溶液V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如右图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是
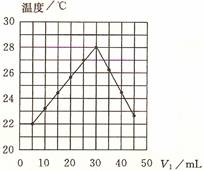 A.做该实验时环境温度为22 ℃
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约是1.00 mol·L-1
D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D是元素周期表中前三周期里的四种元素,A能与D组成AD2型化合物,AD2中核外电子总数是30。离子D-的核外电子排布与Al3+相同,B和C可以形成BC型化合物,BC分子中质子总数是18,BC水溶液是一种强酸,试回答:
(1) 用电子式表示BC的形成过程:___________________________________;
(2) D单质与水反应的化学方程式是:__________________________________;
(3) 比较AD2中两种微粒的半径:r(A2+)_________r(D-)(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
如何用所提供的试剂和方法除去各粉末状混合物中的杂质(括号内为杂质)。将所选答案 的编号填入下表内相应的空格内(如果不需要外加试剂,则对应答案栏可空着)。
可供选择的试剂:A.盐酸 B.氢氧化钠溶液 C.氧气 D.水 E.二氧化碳
可选用的操作:①水洗 ②加热 ③高温灼烧 ④过滤 ⑤结晶
|
| 粉末状混合物 | 选择的试剂 | 选用的操作 |
| (1) | CaCO3(SiO2) | ||
| (2) | NaCl(SiO2) | ||
| (3) | SiO2(Fe2O3) | ||
| (4) | SiO2(CaCO3) | ||
| (5) | SiO2(NH4Cl) |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列不发生反应的一组物质是 ( )
①硅与NaOH溶液 ②硅与盐酸 ③硅与氢氟酸 ④二氧化硅与碳酸钠 ⑤二氧化硅与NaOH溶液 ⑥二氧化硅与浓硝酸
A.①②④ B.③④⑥ C.②⑤⑥ D.②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl(浓)===2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是________(填序号)。
A.只有还原性 B.还原性和酸性
C.只有氧化性 D.氧化性和酸性
②若上述反应中产生0.1 mol ClO2,则转移电子的物质的量为________mol。
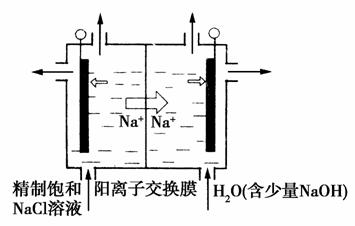
(2)目前已开发出用电解法制取ClO2的新工艺。
①如图装置用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极产生ClO2的电极反应式:__________________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_______
mol,用平衡移动原理解释阴极区pH增大的原因_________。
(3)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含CN- a mol·L-1,现用ClO2将CN-氧化,有两种气体生成,其离子反应方程式为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com