
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。

(1)装置A中盛放亚硫酸钠的仪器名称是________,其中发生反应的化学方程式为_____________
(2)实验过程中,装置B、C中发生的现象分别是_______________、______________,这些现象分别说明SO2具有的性质是______和 。装置B中发生反应的离子方程式为_________;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象_________。
(4)尾气可采用________溶液吸收。
(5)碳单质和浓硫酸会在加热时发生反应,写出反应化学方程式
除去CO2中含有的少量SO2可选择通过 溶液 。
(6)描述实验室稀释浓硫酸的方法
【答案】(1)蒸馏烧瓶;Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(2)B中溶液由紫红色变为无色;C中出现黄色浑浊;还原性;氧化性;2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+;
(3)待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热;无色溶液恢复为红色;
(4)NaOH;
(5) 2H2SO4(浓) + C![]() CO2↑+ 2H2O + 2SO2↑;饱和的碳酸氢钠(或高锰酸钾);
CO2↑+ 2H2O + 2SO2↑;饱和的碳酸氢钠(或高锰酸钾);
(6)浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌。
【解析】
试题分析:(1)装置A中盛放亚硫酸钠的仪器名称是蒸馏烧瓶;亚硫酸钠与浓硫酸反应反应生成硫酸钠、二氧化硫气体和水,反应的化学方程式为:Na2SO3 + H2SO4(浓) = Na2SO4 + SO2↑ + H2O
(2)高锰酸钾溶液为紫红色,具有氧化性,二氧化硫具有还原性,二者发生氧化还原反应,则观察到红色逐渐变浅直至完全褪去,二氧化硫进入硫化钠溶液中发生的氧化还原反应为2S2-+SO2+2H2O=3S↓+4OH-,则观察到出现黄色浑浊,体现了二氧化硫的氧化性;高锰酸钾溶液和二氧化硫气体发生的离子反应为:2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+,故答案为:B中溶液由紫红色变为无色;C中出现黄色浑浊;还原性;氧化性;2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+;
(3)因二氧化硫能使品红褪色,但加热褪色后的溶液又可恢复红色,则操作为待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,观察到的现象为无色溶液恢复为红色,故答案为:待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热;无色溶液恢复为红色;
(4)利用氢氧化钠溶液来吸收尾气,发生的离子反应为SO2+2OH-=SO32-+H2O,故答案为:NaOH;
(5)碳单质和浓硫酸会在加热时发生反应生成二氧化碳和二氧化硫,反应化学方程式为2H2SO4(浓) + C![]() CO2↑+ 2H2O + 2SO2↑,二氧化硫具有还原性,除去CO2中含有的少量SO2可选择通过高锰酸钾溶液,亚硫酸的酸性比碳酸强,也可通过饱和的碳酸氢钠溶液除去,故答案为:2H2SO4(浓) + C
CO2↑+ 2H2O + 2SO2↑,二氧化硫具有还原性,除去CO2中含有的少量SO2可选择通过高锰酸钾溶液,亚硫酸的酸性比碳酸强,也可通过饱和的碳酸氢钠溶液除去,故答案为:2H2SO4(浓) + C![]() CO2↑+ 2H2O + 2SO2↑;饱和的碳酸氢钠(或高锰酸钾);
CO2↑+ 2H2O + 2SO2↑;饱和的碳酸氢钠(或高锰酸钾);
(6)实验室稀释浓硫酸的的操作为浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散,故答案为:浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌。


科目:高中化学 来源: 题型:
【题目】NaCl是一种化工原料,可以制备一系列物质(如图所示)。下列说法正确的是( )
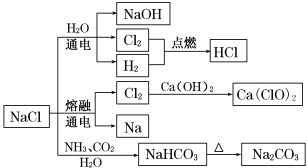
A.25 ℃,NaHCO3在水中的溶解度比Na2CO3的大
B.NaHCO3 受热分解的方程式为:2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.电解饱和氯化钠溶液的方程式为:2NaCl![]() 2Na+Cl2↑
2Na+Cl2↑
D.图中所示转化反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组将下图所示装置按一定顺序连接,在实验室里制取一定量的FeCl3(所通气体过量并充分反应)。

请回答下列问题:
(1)各装置的正确连接顺序为(填写装置代号)A→______→_____→______→______。
(2)装置C的作用是_____________________;装置D的作用是_______________________;装置E的作用是_______________________。
(3)反应开始后,B中硬质玻璃管内的现象为______________________;可以检验生成物中含有Fe3+的试剂是____________(填写试剂名称)。
(4)A中发生反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化过程需要吸收能量的是( )
A. 2H2+O2=2H2O B. CaO+H2O=Ca(OH)2
C. Cl+Cl→Cl2 D. N2→N+N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提纯下列物质(括号内物质为杂质),所选用的除杂试剂和分离方法正确的是
被提纯的物质 | 除杂试剂 | 分离方法 | |
A | 乙酸乙酯(乙醇) | 乙酸 | 加热回流 |
B | 乙烷(乙烯) | 酸性KMnO4 | 洗气 |
C | 乙醇(乙酸) | 新制氧化钙 | 蒸馏 |
D | 苯(溴) | 碘化钾溶液 | 分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是 ( )
A.1 molN2与4 mol H2反应生成的NH3分子数为2NA
B.1 molFe溶于过量硝酸,电子转移数为2NA
C.现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为3NA
D.11.2 L标况下的SO3所含分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在酸性溶液中,下列物质氧化H2S生成S是时,自身发生如下变化: IO3-→I2; Fe3+→Fe2 +; SO2→S;MnO4-→Mn2+ 。如果分别用等物质的量的这些物质氧化足量的H2S,得到S最多的是( )
A.IO3- B.Fe3+ C.SO2 D. MnO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2:约45%,Fe2O3:约40%,Al2O3:约10%,MgO:约5%。目前我国已经在技术上取得突破――用硫酸渣炼铁。Fe3+开始沉淀为氢氧化物的pH=1,沉淀完全时的pH为3.7。某学生探究性学习小组的同学设计了不同的方案,用化学基本知识进行金属元素的提取实验。
方案一:

请回答:
(1)写出固体E的化学式:__________________。试剂①是_______
A.氢氧化钠 B.氧化铝 C.氨水 D.水
(2)若要准确测定溶液的pH是否达到3.7,下列物品中可供使用的是_________
A.石蕊试液 B.广泛pH试纸 C.pH计
(3)溶液H中溶质的化学式:__________________
(4)要将固体C、固体E和固体G都转化为相应的稳定的氧化物,需进行的实验操作为 。
方案二:

(5)此方案制得的氧化铝含有的主要杂质是:_______________
(6)写出由溶液M固体乙这个过程中,主要化学反应的离子方程式:
_____________________;___________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com