
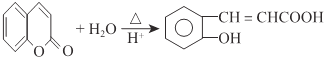
【题目】水杨酸是一种用途极广的消毒防腐剂及医疗保养品,是合成众多药物的中间产物,其工业合成的路线之一如下图所示:

已知:RCH=CHR1 RCOOH+R1COOH
RCOOH+R1COOH
请回答下列问题:
(1)B分子中含氧官能团的名称为_________,D→水杨酸的反应类型为_________。
(2)C转化为D的同时还有一种有机物生成,该物质的结构简式为__________,上述转化过程中B→C的意义是_________;在适当条件下,水杨酸可发生聚合反应生成一种高分子化合物,该化合物的结构简式为__________。
(3)A→B的化学方程式_________。
(4)D有多种同分异构体,符合下列条件的同分异构体最多有_________种,写出核磁共振氢谱有4个峰的物质的结构简式____________。
①是苯的二元取代物;②能发生水解反应及银镜反应
(5)以1,4-二氯丁烷为基本原料制备乙二酸,写出相应的合成路线图(格式为反应物![]() 生成物) ____________
生成物) ____________
【答案】羟基、羧基 取代反应 HOOCCOOH 保护—OH,避免其被KMnO4溶液氧化 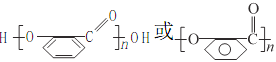
 9
9 ![]() ClCH2CH2CH2CH2Cl
ClCH2CH2CH2CH2Cl![]() CH2=CHCH=CH2
CH2=CHCH=CH2![]() HOOC—COOH
HOOC—COOH
【解析】
由C、D的组成、结构及转化条件可推出C为![]() ,故B为
,故B为![]() ,A为
,A为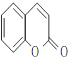 。因B中含有—OH,它易被KMnO4溶液氧化,故B→C的意义是将—OH转化为—OCH3,避免—OH被氧化。D→水杨酸的反应中,D中—CH3被HI中的氢原子代替了,故该反应是取代反应。水杨酸通过发生酯化型的缩聚反应可得到高分子化合物。(4)由①知苯环上有两个取代基,由于知含有酯基且酯基为甲酸酯基。两个取代基可以分别为:—OH~—CH2OOCH、—CH2OH~—OOCH,—OCH3~OOCH。每两个取代基在苯环上均有3种不同的位置关系,故共有9种同分异构体。核磁共振有4种峰,表明结构中存在对称关系,由此可确定其结构简式。(5)根据反应信息知,若要制得乙二酸,需要先制备1.3-丁二烯,故可由原料发生消去反应制得。
。因B中含有—OH,它易被KMnO4溶液氧化,故B→C的意义是将—OH转化为—OCH3,避免—OH被氧化。D→水杨酸的反应中,D中—CH3被HI中的氢原子代替了,故该反应是取代反应。水杨酸通过发生酯化型的缩聚反应可得到高分子化合物。(4)由①知苯环上有两个取代基,由于知含有酯基且酯基为甲酸酯基。两个取代基可以分别为:—OH~—CH2OOCH、—CH2OH~—OOCH,—OCH3~OOCH。每两个取代基在苯环上均有3种不同的位置关系,故共有9种同分异构体。核磁共振有4种峰,表明结构中存在对称关系,由此可确定其结构简式。(5)根据反应信息知,若要制得乙二酸,需要先制备1.3-丁二烯,故可由原料发生消去反应制得。
(1)A反水解反应反应生成B,结合A、B分子式可知A为环状酯类物质,B中含有羧基、羟基,D在HI条件下发生水解反应生成水杨酸,属于取代反应,
故答案为:羧基、羟基;取代反应;
(2)结合水杨酸的结构简式,可知B的结构简式为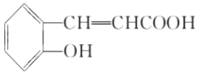 ,再结合B、C、D的转化条件及D的结构简式,可知C为
,再结合B、C、D的转化条件及D的结构简式,可知C为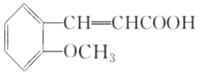 ,C氧化后另外一种有机物为乙二酸,结构简式为HOOC-COOH.因苯环上的酚羟基易被氧化,转化为-OCH3,保护-OH,避免其被KMnO4溶液氧化,水扬酸可发生聚合反应生成一种高分子化合物,该化合物的结构简式为
,C氧化后另外一种有机物为乙二酸,结构简式为HOOC-COOH.因苯环上的酚羟基易被氧化,转化为-OCH3,保护-OH,避免其被KMnO4溶液氧化,水扬酸可发生聚合反应生成一种高分子化合物,该化合物的结构简式为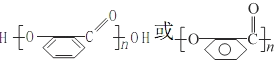 ,
,
故答案为:HOOC-COOH;保护-OH,避免其被KMnO4溶液氧化;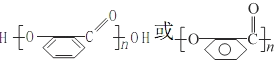 ;
;
(3)A→B发生酯的水解反应生成 ,A的结构简式为
,A的结构简式为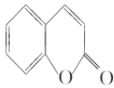 ,反应方程式为:
,反应方程式为: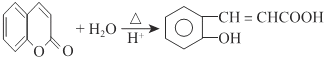 ,
,
故答案为: ;
;
(4)能发生水解反应及银镜反应,说明含有甲酸形成的酯基-OOCH,又是苯的二元取代物,2个取代基为-OOCH、-OCH3,或者为-OOCH、-CH2OH,或者为-CH2OOCH、-OH,各有邻、间、对3种,共有9种,核磁共振氢谱有4个峰的物质的结构简式为:![]() ,
,
故答案为:9;![]() ;
;
(5)ClCH2CH2CH2CH2Cl在氢氧化钠醇溶液、加热条件下发生消去反应生成CH2=CHCH=CH2,然后碱性高锰酸钾溶液氧化,并酸化得到HOOC-COOH,故答案为:ClCH2CH2CH2CH2Cl![]() CH2=CHCH=CH2
CH2=CHCH=CH2![]() HOOC—COOH。
HOOC—COOH。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图所示,室温下分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的1/4)、H2 和O2 的混合气体,若将H2、O2 的混合气体点燃引爆。活塞先左弹,恢复室温后,活塞右滑停留于容器的中央。则原来H2、O2 的物质的量之比可能为①4∶5 ② 2∶5 ③3∶8 ④7∶2
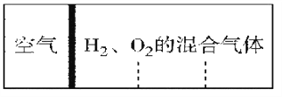
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁(26Fe)、钴(27Co)两种元素均为第四周期元素,它们的用途极为广泛。回答:
(1)26Fe位于元素周期表的第______纵行。
(2)为比较相同浓度的FeCl3溶液和CuSO4溶液对H2O2分解的催化效果,某研究小组进行了如下探究:
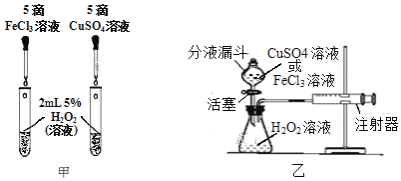
①如图甲,可通过观察______来定性比较两者的催化效果。
②如图乙,要定量比较两者的催化效果,可测量生成等体积气体所需的______。
③在FeCl3溶液中,究竟是哪种粒子起催化作用?
猜想1:铁离子(Fe3+)起催化作用;
猜想2:______起催化作用;猜想3:______起催化作用;……
若要验证猜想1成立,只需要在图甲的两只试管中分别加入同浓度、同体积的______和______,再通过观察现象,即可证明猜想1成立。
(3)请仔细阅读、分析下列有关利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程图,回答下列问题:
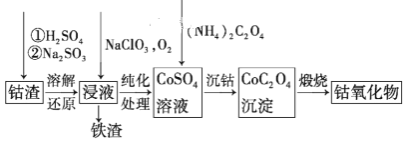
铁渣中铁元素的化合价为______,在空气中煅烧CoC2O4(草酸钴,其中碳为+3价),生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A. 已知2H2(g)+O2(g)=2H2O(l)△H=﹣483.6 kJmol﹣1,则氢气的燃烧热为483.6 kJmol﹣1
B. 在一定温度和压强下,将0.5mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放出热量19.3 kJ,则其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) △H=﹣19.3kJ/mol
2NH3(g) △H=﹣19.3kJ/mol
C. 已知2C(s)+2O2(g)=2CO2(g)△H1 2C(s)+O2(g)=2CO(g)△H2 则△H1>△H2
D. 已知Ni(CO)4(s)=Ni(s)+4CO(g) △H=Q kJmol﹣1,则Ni(s)+4CO(g)=Ni(CO)4(s) △H=﹣Q kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,自来水消毒、农药的生产、药物的合成等都需要用到氯气。
I.工业上通常采用电解法制氯气:观察下图,回答:
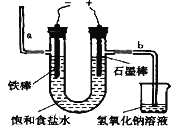
(1)通电后,_____(填“铁棒”或“石墨棒”)电极上产生氯气,若饱和食盐水中含有酚酞,______(填“a”或“b”)侧先变红。
(2)写出该电解反应的化学方程式为_______________________________________。
(3)该装置中,NaOH溶液的作用是____________________________。
II.在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如下图:

(1)连接上述仪器的正确顺序是:E→_______→________→_______→_______→H→G→F。
(2)气体发生装置中进行的反应化学方程式是________________________________;若在标准状态下收集到4.48 L氯气,则被氧化的HCl的物质的量是_______mol。
(3)上面装置中饱和食盐水的作用是__________________。
(4)将新制氯水滴到pH试纸上,现象为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式中正确的是
A.向Ca(HCO3)2溶液加入过量的NaOH溶液:![]()
B.向NH4HCO3溶液中滴入少量NaOH溶液:![]()
C.澄清石灰水与少量小苏打溶液混合::![]()
D.少量氢氧化钡溶液与过量硫酸氢钠混合:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于在一个密闭容器中进行的反应C(s)+H2O(g) ![]() CO(g)+H2(g) ,下列条件的改变对反应速率几乎没有影响的是
CO(g)+H2(g) ,下列条件的改变对反应速率几乎没有影响的是
①增加C的量; ②增加CO的量;
③将容器的体积缩小一半; ④保持体积不变,充入N2以增大压强;
⑤升高反应体系的温度; ⑥保持压强不变,充入N2以增大体积。
A. ②③ B. ①④ C. ①⑥ D. ④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某化学小组用实验的方法进行探究。
I.探究活动一:
备选药品:铁片、锌片、0.5mol/LH2SO4、1.5mol/LH2SO4、18.4mol/LH2SO4
甲同学研究的实验报告
实验步骤 | 现象 | 结论 |
①分别取等体积的1.5mol/L的硫酸于两支试管中; ②_____________________。 | 反应速率: 锌>铁 | 金属的性质越活泼,反应速率越快 |
(1)甲同学实验报告中的实验步骤②为__________________________________。
(2)甲同学的实验目的是_______________________________;要得出正确的实验结论,还需控制的实验条件是__________________。
乙同学为了定量研究浓度对化学反应速率的影响,利用如图所示装置进行实验:

(3)乙同学在实验中需要测定的数据是_________________________。
(4)乙同学不会选用___________mol/L硫酸完成该实验,理由是_________________。
II.探究活动二:
备选药品:0.1mol/LNa2S2O3溶液、0.2mol/LNa2S2O3溶液、0.1mol/LH2SO4溶液、0.2mol/LH2SO4溶液。
已知:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O
实验 编号 | Na2S2O3用量 | H2SO4用量 | 温度(℃) |
① | 0.1mol/L5mL | 0.1mol/L5mL | 10 |
② | 0.2mol/L5mL | 0.2mol/L5mL | 25 |
③ | 0.1mol/L5mL | 0.1mol/L5mL | 25 |
④ | 0.1mol/L5mL | 0.1mol/L5mL | 40 |
(1)若想探究温度对化学反应速率的影响,可选的实验编号有___________。
(2)若想探究浓度对化学反应速率的影响,可选的实验编号有___________。
(3)在该实验过程中,需要观察和记录________________,来比较化学反应速率的快慢。
(4)Na2S2O3在碱性溶液中可被I2氧化为Na2SO4,写出该反应的离子方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物中间体Q、医用材料PVA的合成路线如图。
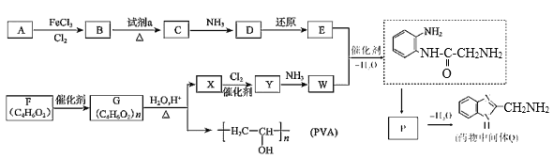
已知:①R-Cl+2NH3→R-NH2+NH4Cl
②R-NO2![]() R-NH2
R-NH2
③-NH2+![]()
(1)A的分子式是________。
(2)B→C是硝化反应,试剂a是________(填名称)。
(3)C→D转化的化学方程式是________。
(4)E的结构简式是________。
(5)F含有的官能团是________(填名称),与其含有相同官能团的同分异构体还有________种。
(6)G→X的化学方程式是________。
(7)W能发生缩聚反应,形成的高分子结构简式是________。
(8)P的结构简式是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com