
| A. | 剩余固体是铜 | |
| B. | 原固体混合物中铜的质量是9.6g | |
| C. | 反应后溶液中n(Fe3+)=0.10mol | |
| D. | 反应后溶液中n(Fe2+)+n(Cu2+)=0.75mol |
分析 由于铁比铜活泼,则与FeCl3溶液反应时的先后顺序为:Fe+2Fe3+=3Fe2+、Cu+2Fe3+=Cu2++2Fe2+,原氯化铁溶液中含有氯化铁的物质的量为:n(FeCl3)=5mol/L×0.1L=0.5mol,结合反应的方程式解答.
解答 解:铁的还原性强于铜,把铁、铜混合粉末加入氯化铁溶液中,铁先与铁离子反应,氯化铁的物质的量是0.5mol,
设0.5mol铁离子完全反应消耗铁、铜的质量分别为m1、m2,则:
Cu+2Fe3+=Cu2++2Fe2+ Fe+2Fe3+=3Fe2+
64g 2mol 56g 2mol
m1 0.5mol m2 0.5mol
m1=$\frac{64g×0.5mol}{2mol}$=16g,
m2=$\frac{56g×0.5mol}{2mol}$=14g,
溶解的金属质量为:18g-2.8g=15.2g,14g<15.2g<16g,则铁完全反应、铜部分反应,
A.根据分析可知,剩余的金属为Cu,故A正确;
B.设反应消耗铜的物质的量为n1,反应的铁的物质的量为n2,则:①64n1+56n2=15.2g、②n1+n2=$\frac{1}{2}$n(Fe3+)=0.25mol,解得:n1=0.15mol、n2=0.1mol,则原来混合物中含有的铜的质量为:0.15mol×64g/mol+2.8g=12.4g,故B错误;
C.由于铜剩余,则Fe3+完全反应,故C错误;
D.根据反应方程式可知反应后溶液中n(Fe2+)=2n(Cu)+3n(Fe)=2×0.15mol+3×0.10mol=0.6mol,反应后溶液中铜离子的物质的量为n(Cu2+)=n(Cu)=0.15mol,故n(Fe2+)+n(Cu2+)=0.6mol+0.15mol=0.75mol,故D正确;
故选AD.
点评 本题考查混合物反应的计算,为高频考点,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题侧重于学生的分析能力和计算能力.


科目:高中化学 来源: 题型:填空题
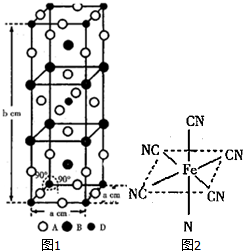
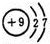
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其它分散系的本质特征是分散质的微粒直径在1nm~100nm之间 | |
| B. | 用平行光照射CuSO4溶液和Fe(OH)3胶体,可以加以区分 | |
| C. | 把FeCl3饱和溶液滴入到NaOH溶液中,以制取Fe(OH)3胶体 | |
| D. | 胶体是一种介稳性的分散系,其粒子能通过滤纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9种 | B. | 6种 | C. | 5种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
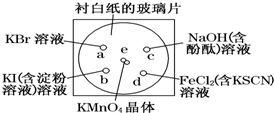 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
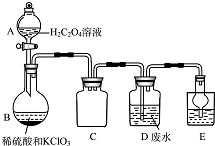 ClO2是一种国际上公认的安全无毒的绿色水处理剂.回答下列问题:
ClO2是一种国际上公认的安全无毒的绿色水处理剂.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:3 | B. | 5:4 | C. | 1:1 | D. | 3:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C2H6O的有机化合物性质相同 | |
| B. | 相同条件下,等质量的碳按a、b两种途径完全转化,途径a比途径b放出更多热能 途径a:C$→_{高温}^{H_{2}O}$CO+H2$→_{燃烧}^{O_{2}}$CO2+H2O 途径b:C$→_{燃烧}^{O_{2}}$CO2 | |
| C. | 食物中可加入适量的食品添加剂,如香肠中可以加少量的亚硝酸钠以保持肉质新鲜 | |
| D. | 生石灰、铁粉、硅胶是食品包装中常用的干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 甲 | 乙 |
| ① | SO2 | 石灰水 |
| ② | CO2 | 石灰水 |
| ③ | SO2 | Ba(NO3)2 |
| ④ | NO2 | CaCl2 |
| A. | ②③④ | B. | ②③ | C. | ①③④ | D. | ①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com