
【题目】将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答下列问题:
(1)NO的体积为________L,NO2的体积为________L。
(2)参加反应的HNO3的物质的量是________。
(3)待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________mol·L-1。
(4)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水________g。
(5)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要通O2______mol。
【答案】5.824 5.376 1.52 mol ![]() 57.8 0.255
57.8 0.255
【解析】
(1)先求出Cu及氮的氧化物的物质的量,然后假设NO的物质的量为x,利用电子守恒建立等量关系式,求出x,也就可得出NO、NO2的体积。
(2)参加反应的HNO3包括生成Cu(NO3)2的硝酸和生成NO、NO2的硝酸,利用前面计算出的二者的物质的量,便可求出参加反应的硝酸的物质的量。
(3) VmLamol·L-1的NaOH溶液中NaOH的物质的量,等于表现出酸性的硝酸与剩余硝酸的物质的量之和,再加上表现出氧化性的硝酸的物质的量,便是原硝酸溶液的物质的量。
(4)利用电子守恒,铜失电子的物质的量,就等于30%的双氧水得电子的物质的量,据此求出双氧水的质量。
(5)通过O2得电子的物质的量,就等于铜失电子的物质的量,从而求出至少需要通O2的物质的量。
(1)n(Cu)=![]() =0.51 mol,设混合气体中NO的物质的量为x,NO2的物质的量为y。
=0.51 mol,设混合气体中NO的物质的量为x,NO2的物质的量为y。
根据气体的总体积为11.2 L知,x+y=0.5 mol,
根据电子守恒知3x+y=(0.51×2) mol,
解方程组得:x=0.26 mol,y=0.24 mol,则:V(NO)=0.26 mol×22.4 L·mol-1=5.824 L,V(NO2)=11.2 L-5.824 L=5.376 L;答案为:5.824;5.376;
(2)参加反应的HNO3分两部分:一部分没有被还原,显酸性,生成Cu(NO3)2;另一部分被还原成NO2和NO,所以参加反应的HNO3的物质的量为0.51 mol×2+0.5 mol=1.52 mol;答案为:1.52 mol;
(3)HNO3在反应中一部分变成气体,一部分以NO![]() 的形式留在溶液中。变成气体的HNO3的物质的量为0.5 mol。加入NaOH溶液至正好使溶液中Cu2+全部转化为沉淀,则溶液中只有NaNO3,其物质的量为10-3aVmol,所以,c(HNO3)=
的形式留在溶液中。变成气体的HNO3的物质的量为0.5 mol。加入NaOH溶液至正好使溶液中Cu2+全部转化为沉淀,则溶液中只有NaNO3,其物质的量为10-3aVmol,所以,c(HNO3)=![]() mol·L-1;答案为:
mol·L-1;答案为:![]() ;
;
(4)由电子守恒得:2×n(Cu)=2×n(H2O2),![]() ×2=n(H2O2)×2,n(H2O2)=0.51mol,则m(H2O2)=17.34 g。需30%的双氧水:17.34 g÷30%=57.8 g。答案为:57.8;
×2=n(H2O2)×2,n(H2O2)=0.51mol,则m(H2O2)=17.34 g。需30%的双氧水:17.34 g÷30%=57.8 g。答案为:57.8;
(5)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,则利用电子守恒,可建立的关系式为2Cu—O2,n(O2)=![]() =0.255mol,所以至少需要通O20.255mol。答案为:0.255。
=0.255mol,所以至少需要通O20.255mol。答案为:0.255。


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH <0,某研究小组研究了其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是
2SO3(g) ΔH <0,某研究小组研究了其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是

A.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响
B.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙的高
D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题。

(1)从实验装置上看,图中有一处仪器未画出的是_____________________。
(2)在其他操作正确的前提下,提高中和热测定准确性的关键是____________。大烧杯上如不盖硬纸板,求得的中和热数值___(填“偏大”“偏小”或“无影响”)
(3)如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将______(填“偏大”、“偏小”、“不变”);原因是___________________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的生成1 mol液态水时放出热量的数值_______________(填“偏大”、“偏小”、“不变”)。
(5)实验中NaOH过量的目的是___________。
(6)若某同学利用上述装置做实验有些操作不规范,造成测得中和热偏小,请分析可能原因(________)。
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.用量筒中的氢氧化钠溶液倒入小烧杯时动作缓慢
C.在量取盐酸时仰视读书
D.大烧杯的盖板中间小孔太大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;
②FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;
③实验②生成的溶液滴在KI试纸上,试纸变蓝
下列判断正确的是( )
A.上述实验证明氧化性:![]() >Cl2>Fe3+>I2
>Cl2>Fe3+>I2
B.上述实验中共有两个氧化还原反应
C.实验①生成的气体不能使湿润的KI试纸变蓝
D.实验②证明Fe2+既有氧化性又有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NaHCO3↓+NH4Cl;2NaHCO3![]() Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
回答下列问题:
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是___(填字母标号)。
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出)。
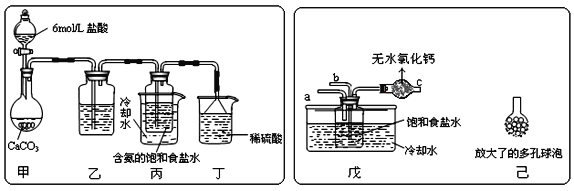
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是___;
(Ⅱ)丁装置中稀硫酸的作用是___;
(Ⅲ)实验结束后,分离出NaHCO3晶体的操作是___(填分离操作的名称)。
②另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从___管通入___气体,再从___管中通入___气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是___;
(3)请你再写出一种实验室制取少量碳酸氢钠的方法:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A2(g)+2B2(g)![]() 2AB2(g) ΔH<0,下列说法正确的是( )
2AB2(g) ΔH<0,下列说法正确的是( )
A. 达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
B. 达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
C. 升高温度有利于反应速率增加,从而缩短达到平衡的时间
D. 升高温度,正向反应速率增加,逆向反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+NO(g)+NO2(g) ![]() 2N2(g)+3H2O
2N2(g)+3H2O![]()
在恒容的密闭容器中,下列有关说法正确的是
A. 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B. 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C. 单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡
D. 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】喷泉实验是中学化学的重要实验。
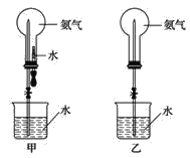
(1)实验室中常用图甲装置进行NH3的喷泉实验。用该装置完成喷泉实验的操作方法是_________。
(2)若用图乙装置进行NH3的喷泉实验,打开止水夹后,烧杯中的液体不能进入烧瓶。请写出引发喷泉实验的一种操作方法:____________。
(3)若将图甲装置中胶头滴管和烧杯中液体改为NaOH溶液,能用改动后的甲装置进行喷泉实验的一组气体是_________(填字母)。
A.HCl和CO2 B.Cl2和CO C.O2和SO2 D.NO2和NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)质量之比为16∶7∶6的三种气体二氧化硫、一氧化碳、一氧化氮,分子数之比为________;氧原子数之比为________;相同条件下的体积之比为__________。
(2)标准状况下,1.7g氨气的体积是________,与其含有相同数目氢原子的硫化氢的体积是__________。
(3)某气体氧化物的化学式为RO2,标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为_________,R的相对原子质量为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com