
某矿样用过量酸溶解并过滤,所得滤液A主要含CO 、Ni2+、SO
、Ni2+、SO 、H+、Fe2+、Fe3+、OH-、Mg2+、Mn2+等九种离子中的七种。将A中金属元素进行分离以备利用,部分流程如图所示:
、H+、Fe2+、Fe3+、OH-、Mg2+、Mn2+等九种离子中的七种。将A中金属元素进行分离以备利用,部分流程如图所示:

可能用到的有关数据如下:
| 物质 | 开始沉淀的pH | 沉淀完全的pH | Ksp(25 ℃) |
| Fe(OH)3 | 2.7 | 3.7 | 4.0×10-38 |
| Fe(OH)2 | 7.6 | 9.6 | 8.0×10-16 |
| Ni(OH)2 | 7.2 | 9.2 | 5.5×10-16 |
| Mg(OH)2 | 9.6 | 11.1 | 1.2×10-11 |
请根据题给信息填空:
(1)滤液A中不能大量存在的两种离子是________。
(2)已知“滤渣1”是MnO2,步骤①发生的氧化还原反应的离子方程式为________。
(3)常温下,某Ni(OH)2、Mg(OH)2共沉淀的混合体系中,若c(Ni2+)=5.5×10-11 mol·L-1,则c(Mg2+)=________。
(4)假定步骤①中NaClO恰好反应,欲检验滤液3中的酸根离子,需优先检验________(填离子符号)。
(5)为测定该矿样中铁元素的含量,取20.0 g矿石,按上述流程操作,将________(填“滤渣1”、“滤渣2”或“滤渣3”)完全酸溶,再使其中的铁元素还原为Fe2+,然后将所得溶液稀释到100 mL,取出20.00 mL用0.100 0 mol·L-1 KMnO4溶液滴定。达到滴定终点时溶液颜色为________色,共消耗KMnO4溶液16. 00 mL,经计算矿样中铁元素的质量分数为________。
解析:本题主要考查工艺流程的分析,意在考查考生对工艺流程的分析能力。(1)过量酸处理后,滤液为酸性,故滤液A中不能大量存在CO 、OH-。(2)步骤①加入的NaClO为强氧化性物质,溶液中的Mn2+、Fe2+均能被氧化,发生反应的离子方程式为Mn2++ClO-+H2O===MnO2↓+2H++Cl-,ClO-+2Fe2++2H+===2Fe3++Cl-+H2O。(3)根据题目所给物质的Ksp数据知,溶液中的c2(OH-)=
、OH-。(2)步骤①加入的NaClO为强氧化性物质,溶液中的Mn2+、Fe2+均能被氧化,发生反应的离子方程式为Mn2++ClO-+H2O===MnO2↓+2H++Cl-,ClO-+2Fe2++2H+===2Fe3++Cl-+H2O。(3)根据题目所给物质的Ksp数据知,溶液中的c2(OH-)=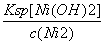 =
=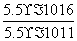 mol2·L-2=1.0×10-5 mol2·L-2,故c(Mg2+)=
mol2·L-2=1.0×10-5 mol2·L-2,故c(Mg2+)= =
=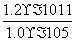 mol·L-1=1.2×10-6 mol·L-1。(4)通过(1)中离子共存的判断可知溶液中一定含有SO
mol·L-1=1.2×10-6 mol·L-1。(4)通过(1)中离子共存的判断可知溶液中一定含有SO ,通过步骤①可知生成Cl-,故滤液3中含有酸根离子为SO
,通过步骤①可知生成Cl-,故滤液3中含有酸根离子为SO 、Cl-。应先检验SO
、Cl-。应先检验SO ,使之转化为BaSO4沉淀,然后再检验Cl-;若先检验Cl-,则SO
,使之转化为BaSO4沉淀,然后再检验Cl-;若先检验Cl-,则SO 与Ag+生成微溶的Ag2SO4,影响Cl-的检验。(5)步骤②调节pH=5,Fe3+生成Fe(OH)3沉淀,故滤渣2为Fe(OH)3,用酸溶解可得Fe3+,再使其中的铁元素还原为Fe2+,Fe2+可被KMnO4氧化,故达到滴定终点时溶液颜色为紫色。反应的离子方程式为:5Fe2++MnO
与Ag+生成微溶的Ag2SO4,影响Cl-的检验。(5)步骤②调节pH=5,Fe3+生成Fe(OH)3沉淀,故滤渣2为Fe(OH)3,用酸溶解可得Fe3+,再使其中的铁元素还原为Fe2+,Fe2+可被KMnO4氧化,故达到滴定终点时溶液颜色为紫色。反应的离子方程式为:5Fe2++MnO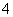 +8H+===5Fe3++Mn2++4H2O,所以100 mL溶液中n(Fe2+)=5×5×0.100 0 mol/L×0.016 00 L=0.04 mol,故矿样中铁元素的质量分数为
+8H+===5Fe3++Mn2++4H2O,所以100 mL溶液中n(Fe2+)=5×5×0.100 0 mol/L×0.016 00 L=0.04 mol,故矿样中铁元素的质量分数为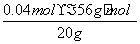 ×100%=11.2%。
×100%=11.2%。
答案:(1)CO 、OH-
、OH-
(2)ClO-+Mn2++H2O===MnO2↓+Cl-+2H+,2H++ClO-+2Fe2+===2Fe3++Cl-+H2O
(3)1.2×10-6 mol·L-1
(4)SO (5)滤渣2 紫 11.2%
(5)滤渣2 紫 11.2%


科目:高中化学 来源: 题型:
已知:稀溶液中,强酸与强碱反应中和热的数值为57.3kJ/mol。
(1)用0.1molBa(OH)2配成的稀溶液跟足量的稀硝酸反应,放出______kJ的热量
(2)1L0.1mol/LNaOH溶液分别与①醋酸溶液②浓硫酸③稀硝酸恰好反应时,放出的热量分别为Q1 、Q2 、Q3(单位:kJ),则它们由大到小的顺序是_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:
Ni(s)+4CO(g)  Ni(CO)4(g),已知该反应在25 ℃和80 ℃时的平衡常数分别
Ni(CO)4(g),已知该反应在25 ℃和80 ℃时的平衡常数分别
为5×104、2。下列说法正确的是
A.恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,Ni(CO)4的百分含量将减小
B.在80 ℃时,测得某时刻Ni(CO)4、CO浓度均为0.5 mol·L-1,则此时v(正)<v(逆)
C.恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动
D.上述生成Ni(CO)4(g)的反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液只可能含有以下离子中的若干种:H+、NH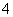 、K+、Mg2+、NO
、K+、Mg2+、NO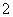 、CO
、CO 、NO
、NO ,现取两份200 mL溶液进行如下实验:(已知HNO2不稳定极易分解2HNO2===H2O+NO2↑+NO↑)
,现取两份200 mL溶液进行如下实验:(已知HNO2不稳定极易分解2HNO2===H2O+NO2↑+NO↑)
①第一份加足量AgNO3溶液后,有11.68 g白色沉淀产生,沉淀中加入足量稀盐酸充分反应,有棕色气体产生,沉淀颜色不变,但是质量减少0.2 g;②将产生的气体全部通入过量的澄清石灰水,又得到白色沉淀2.0 g,该沉淀能溶于稀盐酸产生无色气体;③第二份加入过量浓NaOH溶液,加热使产生的气体全部放出,用100 mL 0.5 mol·L-1的稀硫酸恰好完全吸收,酸也不剩余。
根据上述实验,以下推测不正确的是( )
A.原溶液一定不存在较大浓度的H+、Mg2+
B.原溶液确定含NH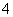 、NO
、NO 、CO
、CO ,且物质的量之比为5:2:1
,且物质的量之比为5:2:1
C.不能确定原溶液是否含有K+、NO
D.实验中产生的棕色气体遇空气颜色会加深
查看答案和解析>>
科目:高中化学 来源: 题型:
NaCl是一种化工原料,可以制备一系列物质(如图),下列说法正确的是( )

A.25 ℃,NaHCO3在水中的溶解度比Na2CO3的大
B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D.如图所示转化反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
从毒韭菜到炸鸡翅、从速溶茶到儿童奶粉,关于食品质量的报道中不断有①“致癌农药”、②“苏丹红”、③“碘元素”、④“亚硝酸盐”、⑤“三聚氰胺”等化学名词出现。业内人士告诉记者,化学性污染正成为危急食品安全的一大“杀手”。上述化学名词所提到的物质中,在某食品添加剂中允许含有但符合限量时不会引起中毒的是( )
A.②③④ B.②③
C.③④ D.只有③
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中 不变
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10 mL pH=11的NaOH溶液,混合液pH <7
查看答案和解析>>
科目:高中化学 来源: 题型:
Hagrmann酯(H)是一种合成多环化合物的中间体,可由下列路 线合成(部分反应条件略去):
线合成(部分反应条件略去):

(1)A→B为加成反应,则B的结构简式是 ;B→C的反应类型是 。
(2)H中含有的官能团名称是 ;F的名称(系统命名)是 。
(3)E→F的化学方程式是 。
(4)TMOB是H的同分异构体,具有下列结构特征:①核磁共振氢谱除苯环吸收峰外仅有1个吸收峰;②存在甲氧基(CH3O-)。TMOB的结构简式是 。
(5)下列说法正确的是 。
a.A能和HCl反应得到聚氯乙烯的单体
b.D和F中均含有2个π键
c.1 mol G完全燃烧生成7 mol H2O
d.H能发生加成、取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com