
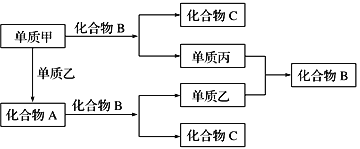
【题目】A、B、C是由周期表中短周期元素组成的三种常见化合物,甲、乙、丙是三种单质,这些单质和化合物之间存在如图所示的关系,完成下列空白:
(1)向酚酞试液中加入化合物A的粉末,现象为________。
(2)单质甲与化合物B反应的离子方程式为__________。5.05g单质甲—钾合金溶于200mL水生成0.075mol氢气,确定该合金的化学式为______ 。
(3)向一定体积某浓度的化合物C的溶液中通人CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示两种情况。
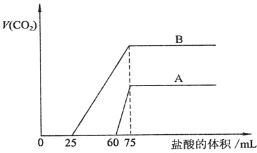
①由A确定滴加前60mL的盐酸时,发生反应的离子方程式为_____________________
②B对应的溶液M低温蒸干后得到固体a克,将a克固体充分加热至恒重后,固体质量减少 _____ 克。
③由A、B可知,两次实验通入的CO2的体积比为___________
【答案】溶液先变红,后褪色,并有气泡2Na+2H2O==2Na++2OH-+H2↑NaK2H+ +OH—==H2O、H++CO32-=HCO3-0.07753:10
【解析】
A、B、C是由周期表中短周期元素组成的三种常见化合物,甲、乙、丙是三种单质,甲与B反应是置换反应,甲与乙是化合反应,丙与乙也是化合反应,单质甲、含有甲元素的化合物A均与化合物B反应得到不同的单质,且两种单质反应又得到化合物B,应是Na、过氧化钠与水的反应,可推知甲是Na单质,乙为氧气,B是H2O,丙为氢气,C是NaOH,A是Na2O2。据此分析可得结论。
(1)向酚酞试液中加入化合物Na2O2的粉末,过氧化钠与水反应生成氢氧化钠与氧气,氢氧化钠使酚酞溶液变红色,但过氧化钠具有漂白性,则现象为:溶液先变红后褪色,并有气泡生成;
(2)单质甲与化合物B反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,根据电子转移守恒可知,Na、K总物质的量为0.075mol×2=0.15mol,设Na、K物质的量分别为xmol、ymol,则:x+y=0.15mol,23g/molx+39g/moly=5.05g,解得x=0.05、y=0.1,故合金的化学式为NaK2;故答案为:2Na+2H2O=2Na++2OH-+H2↑、NaK2;
(3)①曲线A、B,开始没有气体,加入一定体积盐酸后生成气体,生成气体的反应为:HCO3-+H+=H2O+CO2↑,若A中只有Na2CO3,开始发生CO32-+H+=HCO3-,前后两过程消耗HCl的体积相等,实际开始阶段消耗盐酸体积大于产生二氧化碳消耗的盐酸体积,故A曲线表明M中的溶质为NaOH、Na2CO3,则滴加前60mL的盐酸时,发生反应的离子方程式为:H+ +OH—==H2O、H++CO32-=HCO3-;
②B曲线中,前后消耗盐酸的体积之比为1:2,则曲线B表明M中溶质为Na2CO3、NaHCO3,且二者物质的量之比为1:1,设n(Na2CO3)= n(NaHCO3)=x,由钠离子守恒可得:2x+x=0.1mol/L×0.075L=0.0075mol,x=0.0025mol,固体加热时发生反应:2NaHCO3![]() Na2CO3+H2O↑+CO2↑,则减少的质量为生成的水和二氧化碳的质量,其质量为:0.0025mol÷2×62g/mol=0.0775g,故答案为:0.0775;
Na2CO3+H2O↑+CO2↑,则减少的质量为生成的水和二氧化碳的质量,其质量为:0.0025mol÷2×62g/mol=0.0775g,故答案为:0.0775;
③曲线A生成二氧化碳消耗盐酸体积为(75-60)mL=15mL,曲线B生成二氧化碳消耗盐酸体积为(75-25)mL=50mL,由HCO3-+H+=H2O+CO2↑可知,则两次实验通入的CO2的体积之比=15mL:50mL=3:10;故答案为:3:10;


科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种物质在一定条件下具有如图所示的转化关系,下列判断正确的是
![]()
A. 若图中反应均为非氧化还原反应,当W为一元强碱时,则X可能是NaAlO2
B. 若图中反应均为非氧化还原反应,当W为一元强酸时,则X可能是NH3
C. 若图中反应均为氧化还原反应,当W为非金属单质时,则Z可能是CO2
D. 若图中反应均为氧化还原反应,当W为金属单质时,则Z可能是FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示实验装置,烧瓶内充满氯气,底部有一层细沙(不参与反应),玻璃导管下口b处塞有一小块钠。从a口伸入一根细铁丝把钠块捅下去,再用滴管从a口滴下一滴水,恰好落在钠块上,立即剧烈反应。下列对此实验的说法中,不正确的是()

A. 所充氯气应用向上排空气法收集
B. 反应中,烧瓶内产生大量白色烟雾
C. 玻璃导管只起到定位加入钠和水的作用
D. 烧瓶中Cl2,可能参与四个氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(选修5——有机化学基础)
呋喃(C4H4O)是生产抗流感药物磷酸奥司他韦(又名达菲)的原料之一,以玉米芯为原料制备呋喃及相关衍生物的一种工艺流程如下:
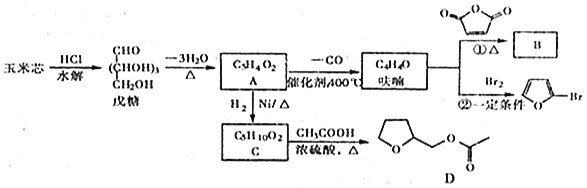
已知:ⅰ)A可以发生银镜反应
ⅱ)![]()
(1)D的分子式为___________________。
(2)呋喃的结构简式为___________;②的反应类型为________________。
(3)A发生银镜反应的化学方程式 ____________________________________________。
(4)C生成D的化学方程式__________________________________________。
(5)反应①在有机合成中具有重要意义,则B的结构简式为__________ 。
(6)C的同分异构体中,含有“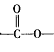 ”结构的共有____________ 种(不含立体导构),其中能发生很镜反应,且核磁共振氢谱中有2组吸收峰的有机物的结构简式为________ 。
”结构的共有____________ 种(不含立体导构),其中能发生很镜反应,且核磁共振氢谱中有2组吸收峰的有机物的结构简式为________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极材料分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应式为Zn+2OH2e===Zn(OH)2,Ag2O+H2O+2e===2Ag+2OH。下列叙述中正确的是( )
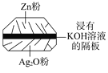
A. 在使用过程中,电解质KOH不断被消耗
B. 使用过程中,电子由Ag2O极经外电路流向Zn极
C. Zn电极发生还原反应,Ag2O电极发生氧化反应
D. Zn是负极,Ag2O是正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T℃时,向V L的密闭容器中充入一定量的A和B,发生的反应为A(g)+B(g)![]() C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如表所示。下列说法不正确的是
C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如表所示。下列说法不正确的是
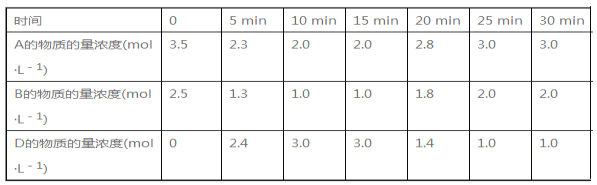
A. 前10 min的平均反应速率v(D)=0.3 mol·L-1·min-1
B. 该反应的平衡常数表达式为K=c(C)c2(D)/[c(A)c(B)]
C. 若达到平衡时保持温度不变,压缩容器体积,平衡不移动
D. 反应至15 min时,改变的条件可以是降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色.如图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl﹣)生产CuCl的流程:
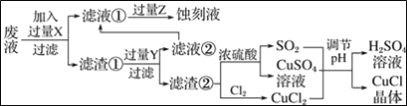
根据以上信息回答下列问题:
(1)写出生产过程中所加试剂:X_______,Y________
(2)生产中为了提高CuCl产品的质量,采用抽滤法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是_________________;生产过程中调节溶液的pH不能过大的原因是__
(3)写出产生CuCl的化学方程式:__________________________________
(4)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[选修3:物质结构与性质]东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为______3d能级上的未成对电子数为_______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
氨的沸点______(填“高于”或“低于”)膦(PH3),原因是_________________
氨是______分子(填“极性”或“非极性”),中心原子的轨道杂化类型为______。
(3)单质铜及镍都是由______键形成的晶体;元素铜与镍的第二电离能分别为ICu=1 958 kJ·mol–1、INi=1 753 kJ·mol-1,ICu>INi的原因是_______________________________。
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是用石墨和铁作电极电解饱和食盐水的装置,请填空:
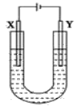
(1)X的电极名称是________极,发生的电极反应式为:_______________________。Y极的电极材料是__________,检验X极产物的方法是___________________________________________。
(2)写出该电极总反应的离子方程式:___________________________________。
(3)若食盐水为100mL 两极共放出2.24L气体(标准状况),则电路中通过电子的物质的量为___________。(假定电解后仍为100mL)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com