
| 实验方法 | 实验方案 | 测量数据 | |
| A | 滴定法 | 将样品配成100mL溶液,取10.00mL,加人甲基橙,用标准盐酸滴定 | 消耗盐酸的体积 |
| B | 量气法 | 将样品与盐酸反应,使生成的气体全部被碱石灰吸收 | 碱石灰增重 |
| C | 重量法 | 将样品放人烧杯中,置于天平上,加入足量盐酸 | 减轻的质量 |
| D | 量气法 | 将样品与盐酸反应,气体通过排水量气装置量气 | 排水体积 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.用甲基橙作指示剂,发生Na2CO3+2HCl=2NaCl+H2O+CO2↑,根据HCl的物质的量可确定Na2CO3的含量;
B.CO2中含有水蒸气;
C.CO2挥发带出水蒸气;
D.CO2能溶于水,不能用排水法收集.
解答 解:A.用甲基橙作指示剂,发生Na2CO3+2HCl=2NaCl+H2O+CO2↑,根据HCl的物质的量可确定Na2CO3的含量,故A正确;
B.CO2中含有水蒸气,碱石灰吸收水蒸气,导致结果偏大,故B错误;
C.CO2挥发带出水蒸气,溶液质量减少,所以导致结果偏大,故C错误;
D.CO2能溶于水,不能用排水法收集,可用排饱和碳酸氢钠溶液的方法收集,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,明确元素化合物性质及实验原理是解本题关键,注意二氧化碳的溶解性、碱石灰的性质,题目难度不大.


 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色 | |
| B. | 乙酸乙酯的制备实验中,饱和Na2CO3溶液不仅可以降低乙酸乙酯的溶解度,还能吸收挥发出来的乙醇及乙酸 | |
| C. | “中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用 | |
| D. | 除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 呈中性 | B. | 呈碱性 | C. | 呈酸性 | D. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红磷转化为白磷,属于物理变化 | |
| B. | 石墨导电、金刚石不导电,故二者不是同素异形体 | |
| C. | O2和O3分子式不同,结构相同 | |
| D. | 单质硫有S2、S4、S6等,它们都是硫的同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中短周期都是主族元素 | |
| B. | 原子核外在离核较远区域的电子易失去,其原因是这些电子的能量较高 | |
| C. | 通过化学变化可以实现16O与18O间的相互转化 | |
| D. | 对于吸收能量的反应必需加热才能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
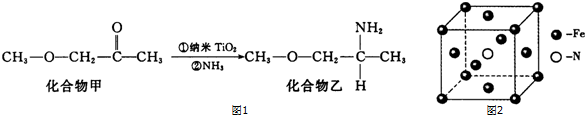
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素丙的单质可用于冶炼金属 | B. | 甲与丁形成的分子是酸性氧化物 | ||
| C. | 简单离子半径:丁>乙>丙 | D. | 甲与乙形成的化合物均有强氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com