
| A、用石墨电极电解Ca(NO3)2溶液,当转移电子数为0.2NA时,阴极析出4g金属 |
| B、0.1mol 24Mg32S晶体中所含中子总数为2.8NA |
| C、常温下含有NA个NO2、N2O4分子的混合气体,温度降至标准状况,其体积约为22.4L |
| D、在熔融状态下,1mol NaHSO4完全电离出的阳离子数目为2NA |


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
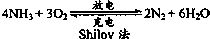 以氨气代替氢气来研发氨燃料电池是当前科研的一个热点.氨燃料电池使用的电解质溶液是KOH溶液,电池反应如图:有关下列说法错误的是( )
以氨气代替氢气来研发氨燃料电池是当前科研的一个热点.氨燃料电池使用的电解质溶液是KOH溶液,电池反应如图:有关下列说法错误的是( )| A、氨燃料电池在充电时,OH-向电池的负极移动 |
| B、氨燃料电池在放电时,负极反应为:2NH3-6e-+6OH-═N2+6H2O |
| C、以氨气代替氢气的主要原因是:氨气易液化易储存 |
| D、燃料电池的能量转化率一般比普通的电池高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、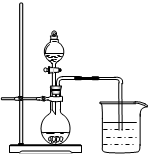 向Ⅰ中通入过量CO2,出现白色沉淀,则溶液中一定含有AlO2- |
B、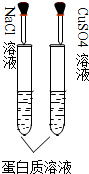 两支试管中蛋白质溶液均会变性 |
C、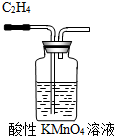 除去C2H4中的SO2 |
D、 海带灼烧成灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、HCO3-、SO32-、OH- |
| B、Al3+、H+、SiO32-、I- |
| C、Fe2+、K+、NO3-、SO42- |
| D、Fe3+、NH4+、ClO-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
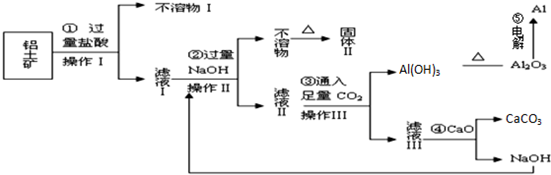
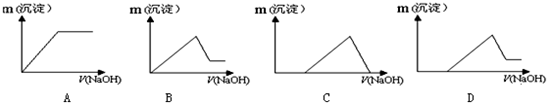
查看答案和解析>>
科目:高中化学 来源: 题型:
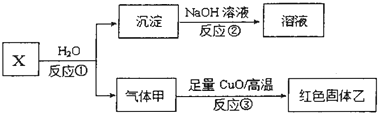
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | |||||||||||||||||
| D | E | F | |||||||||||||||
| B | C | G | H | I | J |
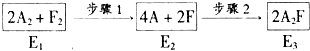
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com