
【题目】已知汽车尾气无害化处理反应为2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)。下列说法不正确的是
N2(g)+2CO2(g)。下列说法不正确的是
A. 汽车尾气中有毒的NO和CO气体经充分反应后,理论上可完全转化为N2和CO2
B. 使用高效催化剂可有效增大正反应速率
C. 反应达到平衡后,NO的反应速率保持恒定
D. 单位时间内CO和CO2减少的物质的量相等时,反应达到平衡
【答案】A
【解析】
A. 汽车尾气无害化处理反应为2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),该反应为可逆反应, 在一定条件下NO和CO气体经充分反应后将达到化学平衡状态,任何一种反应物的转化率不可能达到100%,所以理论上NO和CO不可能完全转化为N2和CO2,另外,也无法保证NO和CO的体积比为1:1,A不正确;B. 使用高效催化剂可有效增大正反应速率,因为催化剂可以降低反应的活化能,B正确;C. 反应达到平衡后,NO的反应速率保持恒定,正反应速率和逆反应速率相等都保持不变了,C正确;D. 单位时间内CO和CO2减少的物质的量相等时,说明正反应速率和逆反应速率相等,所以反应达到平衡,D正确。本题选A。
N2(g)+2CO2(g),该反应为可逆反应, 在一定条件下NO和CO气体经充分反应后将达到化学平衡状态,任何一种反应物的转化率不可能达到100%,所以理论上NO和CO不可能完全转化为N2和CO2,另外,也无法保证NO和CO的体积比为1:1,A不正确;B. 使用高效催化剂可有效增大正反应速率,因为催化剂可以降低反应的活化能,B正确;C. 反应达到平衡后,NO的反应速率保持恒定,正反应速率和逆反应速率相等都保持不变了,C正确;D. 单位时间内CO和CO2减少的物质的量相等时,说明正反应速率和逆反应速率相等,所以反应达到平衡,D正确。本题选A。


 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4 L水含有的水分子数为NA
B. 常温常压下,22 g CO2含有的CO2分子数为0.5NA
C. 标准状况下,32 g O2和CO2的混合气体含有的氧原子数为2NA
D. 40 g NaOH溶解在1 L水中,得到溶液的物质的量浓度为1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水体中硝酸盐造成的污染已成为突出的环境问题。某课题组研究了去除不同各种水体中NO3-的方法。
(1)用铝粉去除饮用水中NO3-的一种方案如下:
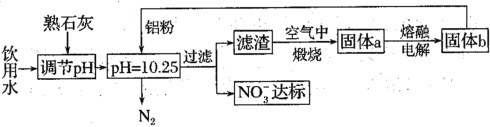
①用熟石灰而不用NaOH调节pH的主要原因是___。在调节pH时,若pH过大或过小都会造成Al的利用率降低。写出pH过大造成Al利用率降低的离子方程式___。
②在加入铝粉去除NO3-的反应中,氧化产物和还原产物的物质的量之比为___。
(2)用铁粉处理pH=2.5的含NO3-废水,测得溶液中相关离子浓度、pH随时间的变化关系如图(部分副反应产物略去):
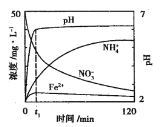
①t1时刻前,该反应的离子方程式为___。
②研究表明:铁粉还原含NO3-废水时,加入活性碳粉可以提高去除NO3-的速率,可能的原因是___。
(3)用Pt作电极电解含NO3-的酸性废水,原理如图。N为电源的___(选填“正”或 “负”)极,与直流电源M端相连的Pt电极上的电极反应式为___。
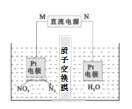
(4)课题组以钛基氧化物涂层材料为惰性阳极、碳纳米管修饰的石墨为阴极,控制一定条件,电解含大量NO3-、SO42-的废水,可使NO3-变为NH4+。研究发现:其他条件不变,废水中加一定量NaCl,去除NH4+的效果明显提高,溶液中氮元素含量显著降低,可能的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语表示Na2CO3+2Cl2===2NaCl+Cl2O+CO2中的相关微粒,其中正确的是( )
A. Na+的结构示意图:![]()
B. Cl2O的结构式:Cl—O—Cl
C. 中子数比质子数多3的氯原子:3517Cl
D. CO2的电子式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )
A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-
B.x=0.6a,2Br-+Cl2=Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。某厂为了变废为宝,将工业废水(含5.00×10-3 mol·L-1的Cr2O72-)处理得到磁性材料Cr0.5Fe1.5FeO4,设计了如下实验流程:
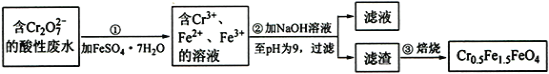
(1)第①步反应的离子方程式是_____。
(2)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有_____。
(3)为保证磁性材料的质量,应控制第①步反应后所得溶液中Fe3+与Fe2+的比例为___。在第②步过程中,须持续通入N2,原因是____________。
(4)将FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是_____。
(5)以工业碳酸钙(含有少量A12O3、Fe3O4杂质)生产二水合氯化钙(CaC12·2H2O)的方法为:将工业碳酸钙溶于盐酸,________得到CaC12·2H2O。(在横线上补全实验步骤,实验中需用到的试剂和仪器有:盐酸,双氧水,氢氧化钙,冰水,pH计)。有关离子开始沉淀及沉淀完全时的pH见下表
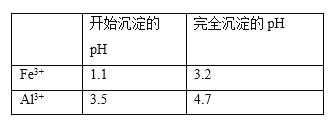
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3和NaHCO3是两种常见的钠盐.
(1)用洁净的铂丝蘸取Na2CO3粉末置于酒精灯火焰上灼烧,火焰呈_____色.
(2)等质量的Na2CO3和NaHCO3分别与足量的盐酸反应,在相同条件下产生CO2的体积V(Na2CO3)_____V(NaHCO3)(填“大于”,“小于”或“等于”)
(3)若加热10.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了2.48g,则原混合物中碳酸钠的质量分数为_____.
(4)实验室中需2mol/L的Na2CO3溶液950mL,配制时应选用容量瓶的规格和称取Na2CO3的质量是_____.
A. 1000mL; 212g B.950mL;543.4g C.任意规格; 572g D.500mL; 106g
(5)若出现如下情况,其中将引起所配溶液浓度偏高的是_____(填下列编号);
A.容量瓶实验前用蒸馏水洗干净,但未烘干
B.定容观察液面时俯视
C.未冷却至室温就开始定容
D.加蒸馏水时不慎超过了刻度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是由短周期元素组成的一些单质及其化合物之间的转化关系图。常温常压下,D、F、K均为无色无刺激性气味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体。(反应中生成的部分物质已略去)
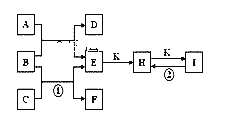
请回答下列问题:
(1)物质A的化学式为________;物质D的名称________;
(2)化合物I的化学式为_____________________;
(3)反应①的化学方程式为_______________________________________;
反应②的化学方程式为_______________________________________;
A与B反应的化学方程式________________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是实验室制取和收集氨气的装置图。回答下列问题:
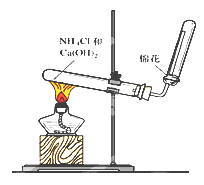
(1)写出实验室制取氨气的化学方程式__________________
(2)图中用于加热的仪器名称是___________该实验发生装置中的试管口略低于试管底的原因是____________________
(3)用蘸有浓盐酸的玻璃棒靠近收集氨气的试管管口,当观察到_____________现象时,可证明氨气已收集满。
(4)用_______________试剂干燥氨气。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com