
分析 n(Cu)=$\frac{12.8g}{64g/mol}$=0.2mol,与硝酸反应Cu失去电子,结合元素的化合价及电子守恒计算.
解答 解:(1)n(Cu)=$\frac{12.8g}{64g/mol}$=0.2mol,铜消耗完时转移电子为0.2mol×(2-0)=0.4mol,
答:总共转移的电子为0.4mol;
(2)将反应得到的气体与一定体积(标况下)的O2混合通入水中,恰好完全吸收,可知Cu失去电子=氧气得到电子,则O2的体积是$\frac{0.4mol}{[0-(-2)]×2}$×22.4L/mol=2.24L,
答:O2的体积是2.24L.
点评 本题考查氧化还原反应的计算,为高频考点,把握元素的化合价变化及电子守恒为解答的关键,侧重分析与计算能力的考查,(2)为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:解答题
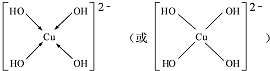 .(用→标出配位键)1mol[Cu (OH)4]2-中有8mol σ键.
.(用→标出配位键)1mol[Cu (OH)4]2-中有8mol σ键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素的相对原子质量的近似值一定是(m+n) | |
| B. | 不能由此确定该元素的相对原子质量 | |
| C. | 若12C的质量为Wg,则该原子的质量约为(m+n)Wg | |
| D. | 若NA表示阿伏加德罗常数,则该原子的摩尔质量为(m+n)•NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,加水稀释后,n(H+)•n(OH-)的乘积不变 | |
| B. | 离子浓度关系:3c(Fe3+)+c(NH4+)+c(H+)=c(OH-)+2c(SO42-) | |
| C. | 溶液呈酸性是因为NH4++H2O?NH3H2O+H+ | |
| D. | 温度升高(假设溶液的体积没有变化)溶液的pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子数和气体质量均不同 | B. | 分子数和中子数均相同 | ||
| C. | 质子数和中子数均相同 | D. | 分子数、原子数和质子数均相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 理论解释 |
| A | N原子的第一电离能大于O原子 | N原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子中C=O之间的夹角为120° |
| C | H2O的沸点大于H2S的沸点 | H2O是液态的,H2S是气态的 |
| D | HF比HCl稳定 | HF分子间可以形成氢键 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com