
【题目】X、Y、Z为短周期元素,X的最外层电子数是Y原子最外层电子数的2倍,Y的原子序数比X的原子序数多5,Z原子的最外层电子数比Y多3。下列叙述正确的是( )
A.原子半径的大小顺序:Y>Z>X
B.Z单质与X单质直接反应可生成两种化合物
C.工业上,电解X和Y形成的化合物制取Y单质
D.Y、Z元素的最高价氧化物的水化物不能互相反应
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:
【题目】将一包由Cu、![]() 和CuO组成的混合物均分成两份:一份混合物在加热条件下与
和CuO组成的混合物均分成两份:一份混合物在加热条件下与![]() 充分反应,将固体全部转化成铜粉时固体质量减少了
充分反应,将固体全部转化成铜粉时固体质量减少了![]() ;向另一份混合物中加入
;向另一份混合物中加入![]() 溶液恰好完全反应生成
溶液恰好完全反应生成![]() 和
和![]() 假设不产生其他还原产物
假设不产生其他还原产物![]() ,这些NO和
,这些NO和![]() 标准状况
标准状况![]() 混合并通入足量水中,气体全部被吸收生成
混合并通入足量水中,气体全部被吸收生成![]() 。则该硝酸的物质的量浓度为
。则该硝酸的物质的量浓度为![]()
![]()
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得到下图,则曲线a、b、c、d所对应的实验组别是
组别 | c(HCl)/molL-1 | 温度/℃ | 状态 |
1 | 2.0 | 25 | 块状 |
2 | 2.5 | 30 | 块状 |
3 | 2.5 | 50 | 粉末状 |
4 | 2.5 | 30 | 粉末状 |
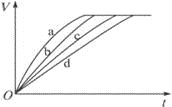
A.4-3-2-1
B.1-2-3-4
C.3-4-2-1
D.1-2-4-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年国际计量大会将摩尔的定义修改为:1摩尔包含6.02214076×1023个基本单元,这一常数被称为阿伏加德罗常数(NA),通常用6.02×1023mol-1表示,新定义于2019年5月20日正式生效。下列说法不正确的是( )
A.标准状况下,22.4L的NH3约含有17×6.02×1023个质子
B.白磷分子(P4)呈正四面体结构,62g白磷中约含有3×6.02×1023个P-P键
C.标准状况下,18gH2O中约含有2×6.02×1023个氢原子
D.由新定义可知,阿伏加德罗常数表达为NA=6.02214076×1023 mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于![]() 的说法正确的是
的说法正确的是
A. 最多有7个原子在同一直线上 B. 最多有7个碳原子在同一直线上
C. 所有碳原子可能都在同一平面上 D. 最多有18个原子在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解饱和食盐水(含少量Ca2+、Mg2+)并进行相关实验,电解一段时间后,各部分装置及对应的现象如下:

对应现象 | (1)中黑色固体变红 | (2)电极a附近溶液出现浑浊 | (3)中溶液出现浑浊 | (4)中溶液红色褪去 |
下列对实验现象解释不正确的是( )
A.(1)中:CuO+H2![]() Cu+H2O
Cu+H2O
B.(2)中a电极:2H2O+2e-=H2↑+2OH-,Mg2++2OH-=Mg(OH)2↓
C.(3)中:Cl2+S2-=S↓+2Cl-
D.(4)中:Cl2+H2O![]() HCl + HClO
HCl + HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D、E、F为原子序数依次增大的五种短周期主族元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B单质在D单质中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A单质在F单质中燃烧,产物溶于水得到一种强酸。用相应的化学用语回答下列问题:
(1)F在周期表中的位置是___,E2D2的电子式为___。
(2)AFD的结构式为___,BD2的电子式为___。
(3)EDA的电子式为___,AF的电子式为___。
(4)B元素形成的化合物种类繁多的原因可能是(填序号)___。
①碳原子之间成键方式多样化,碳碳之间可以单键、双键或者叁键
②同分异构现象的普遍存在
③碳碳之间可以通过共价键彼此结合成链状或者环状
(5)元素D、E、F形成的简单离子的半径由大到小为__(用离子符号表示)。
(6)用电子式表示E与F形成化合物的过程___。
(7)写出E与D形成的既含离子键又含共价键的化合物与水反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组按下列路线合成镇痛药哌替啶M。

已知:ⅰ.R—NH2+![]()
![]() RNHCH2CH2OH
RNHCH2CH2OH
ⅱ.![]()
(1)A→B的化学方程式是__。
(2)B→C的反应类型是__。
(3)D的核磁共振氢谱只有一个吸收峰,其结构简式是__。
(4)D→E的化学方程式是__。
(5)G中含有两个六元环,其结构简式是__。
(6)I和H反应生成镇痛药哌替啶M的化学方程式是__。
(7)写出同时符合下列条件的C的同分异构体的结构简式__(写出一种即可)。
①分子中有苯环且是苯的邻位二取代物;
②核磁共振氢谱表明分子中有6种氢原子;红外光谱显示存在碳氮双键(C=N)。
(8)以C为原料可以合成重要的医药中间体对氨基苯乙酸,合成路线如下:
![]()
①写出Y的结构简式__。
②合成路线中反应条件Fe/HCl的作用是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸的电离方程式为CH3COOH(aq)![]() H+(aq)+CH3COO-(aq) ΔH>0。25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka=c(H+).c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
H+(aq)+CH3COO-(aq) ΔH>0。25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka=c(H+).c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
A. 向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)减小
B. 向该溶液中加少量CH3COONa固体,平衡正向移动
C. 该温度下0.01mol/L醋酸溶液Ka<1.75×10-5
D. 升高温度,c(H+)增大,Ka变大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com