

科目:高中化学 来源: 题型:阅读理解
阅读下列实验内容,根据题目要求回答问题。
某学生测定未知浓度的硫酸溶液,实验如下:用1.00 mL待测硫酸配制100.00mL稀H2SO4溶液;取上述稀H2SO4 25.00 mL用0.14 mol·L-1的NaOH溶液滴定,消耗NaOH溶液15.00 mL。
(1)该学生用标准0.14 mol·L-1NaOH溶液滴定硫酸的实验操作如下:
A用酸式滴定管取稀H2SO425.00 mL,注入锥形瓶中,加入2滴酚酞。
B、用待测定的溶液润洗酸式滴定管。
C、用蒸馏水洗干净滴定管。
D、取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2—3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E、检查滴定管是否漏水。
F、另取锥形瓶,再重复操作一次。
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写)E→ C → D→_________→_________→_________→F;
②在G操作中如何确定终点?____________。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果
(填“偏小”、“偏大”或“无影响”)_________。
(3)配制准确浓度的稀H2SO4溶液,必须使用的主要仪器是(写一种)_________。
(4)如有1.00 mol/L和0.10 mol/L的NaOH溶液,应用 ____________的NaOH溶液,原因是____________。
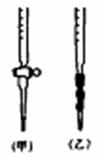
(5)用标准NaOH溶液滴定时,应将标准NaOH溶液注入_________(选填“甲”或“乙”)中。(下图)
(6)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值_________(选填“偏大”“偏小”或“无影响”)。
(7)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度_________(计算结果到小数点后二位)。
查看答案和解析>>
科目:高中化学 来源:2010-2011年陕西西安临潼区华清中学高二重点班第二次月考化学试卷(解析版) 题型:实验题
阅读下列实验内容,根据题目要求回答问题。
某学生测定未知浓度的硫酸溶液,实验如下:用1.00 mL待测硫酸配制100.00 mL稀H2SO4溶液;取上述稀H2SO4 25.00 mL用0.14 mol·L-1的NaOH溶液滴定,消耗NaOH溶液15.00 mL。
(1)该学生用标准0.14 mol·L-1 NaOH溶液滴定硫酸的实验操作如下:
A用酸式滴定管取稀H2SO4 25.00 mL,注入锥形瓶中,加入2滴酚酞。
B、用待测定的溶液润洗酸式滴定管。
C、用蒸馏水洗干净滴定管。
D、取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2—3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E、检查滴定管是否漏水。
F、另取锥形瓶,再重复操作一次。
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写)E→ C → D→_________→_________→_________→F;
②在G操作中如何确定终点?____________。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果
(填“偏小”、“偏大”或“无影响”)_________。
(3)配制准确浓度的稀H2SO4溶液,必须使用的主要仪器是(写一种)_________。
(4)如有1.00 mol/L和0.10 mol/L的NaOH溶液,应用 ____________的NaOH溶液,原因是____________。
(5)用标准NaOH溶液滴定时,应将标准NaOH溶液注入_________(选填“甲”或“乙”)中。(下图)
(6)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值_________(选填“偏大”“偏小”或“无影响”)。
(7)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度_________(计算结果到小数点后二位)。
查看答案和解析>>
科目:高中化学 来源:2010-2011年陕西西安临潼区华清中学高二重点班第二次月考化学试卷(解析版) 题型:实验题
阅读下列实验内容,根据题目要求回答问题。
某学生测定未知浓度的硫酸溶液,实验如下:用1.00 mL待测硫酸配制100.00 mL稀H2SO4溶液;取上述稀H2SO4 25.00 mL用0.14 mol·L-1的NaOH溶液滴定,消耗NaOH溶液15.00 mL。
(1)该学生用标准0.14 mol·L-1 NaOH溶液滴定硫酸的实验操作如下:
A用酸式滴定管取稀H2SO4 25.00 mL,注入锥形瓶中,加入2滴酚酞。
B、用待测定的溶液润洗酸式滴定管。
C、用蒸馏水洗干净滴定管。
D、取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2—3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E、检查滴定管是否漏水。
F、另取锥形瓶,再重复操作一次。
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写)E→ C → D→_________→_________→_________→F;
②在G操作中如何确定终点?____________。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果
(填“偏小”、“偏大”或“无影响”)_________。
(3)配制准确浓度的稀H2SO4溶液,必须使用的主要仪器是(写一种)_________。
(4)如有1.00 mol/L和0.10 mol/L的NaOH溶液,应用 ____________的NaOH溶液,原因是____________。
(5)用标准NaOH溶液滴定时,应将标准NaOH溶液注入_________(选填“甲”或“乙”)中。(下图)

(6)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值_________(选填“偏大”“偏小”或“无影响”)。
(7)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度_________(计算结果到小数点后二位)。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(11分)请仔细阅读下图和文字说明,回答后面提出的问题:
![]()
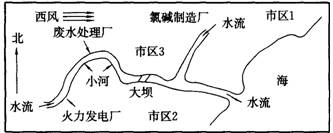
右图所示的区域包括三个市区,一个氯碱制造厂,一个废水处理厂和一个火力发电厂,两个厂都向河里排放污水。
![]() (1)火力发电厂使用的燃料煤中含有少量的硫,燃烧的气体未经处理即排放到空气中,又有部分发电用水未经冷却排入附近的河中,经观察其下游几十公里范围内的河水中鱼类几乎绝迹,其原因是 。
(1)火力发电厂使用的燃料煤中含有少量的硫,燃烧的气体未经处理即排放到空气中,又有部分发电用水未经冷却排入附近的河中,经观察其下游几十公里范围内的河水中鱼类几乎绝迹,其原因是 。
![]() (2)由于SO2是形成酸雨的罪魁祸首之一。近闻美国和日本正在研究用Na2SO3吸收法作为治理SO2污染的一种新方法,第一步是用Na2SO3吸收SO2;第二步是加热吸收液,使之重新生成Na2SO3,同时得到含高浓度SO2的水蒸气副产品。请参照酸碱盐的转化关系,按顺序写出上述两步反应的化学方程式: ;。
(2)由于SO2是形成酸雨的罪魁祸首之一。近闻美国和日本正在研究用Na2SO3吸收法作为治理SO2污染的一种新方法,第一步是用Na2SO3吸收SO2;第二步是加热吸收液,使之重新生成Na2SO3,同时得到含高浓度SO2的水蒸气副产品。请参照酸碱盐的转化关系,按顺序写出上述两步反应的化学方程式: ;。
![]() (3)火力发电厂的电能输送到氯碱制造厂进行NaOH、Cl2和H2的制备。如果氯碱厂采用电解饱和食盐水的方法,则反应方程式为 ,NaOH将在电解装置的 极产生,可用下列最简单的化学方法证明电解时生成NaOH 。
(3)火力发电厂的电能输送到氯碱制造厂进行NaOH、Cl2和H2的制备。如果氯碱厂采用电解饱和食盐水的方法,则反应方程式为 ,NaOH将在电解装置的 极产生,可用下列最简单的化学方法证明电解时生成NaOH 。
(4)科研人员为减少火力发电厂对环境的污染,曾经考虑让火力发电厂和氯碱制造厂进行横向联合。请你判断该方案是否可行? ;如果可行,请简述该方案的优点是 ,如果涉及到化学反应,其化学反应是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com