
| A. | ⑤ | B. | ④ | C. | ③ | D. | ② |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径10-9m~10-7 m | |
| B. | 胶体在生物界普遍存在,应用也很广泛 | |
| C. | 用平行光照射氢氧化铁胶体产生一条光路,是由于光照使之发生分解生成氧化铁 | |
| D. | 氢氧化铁胶体净水是利用了胶体的吸附性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含氧酸的酸性:H3ZO4>H2YO4>HXO4 | |
| B. | 非金属性:X>Y>Z | |
| C. | 气态氢化物的稳定性按X、Y、Z顺序由弱到强 | |
| D. | 元素的负化合价的绝对值按X、Y、Z顺序由小到大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
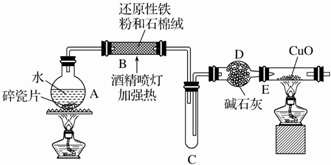
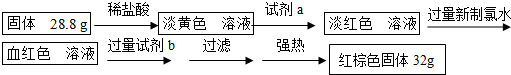
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青蒿素的摩尔质量是282 g/mol | |
| B. | 从植物黄花蒿茎叶中提取青蒿素可能会经过一系列复杂的变化 | |
| C. | 从题干信息推测,青蒿素应属于原子晶体 | |
| D. | 服用青蒿素治疗疟疾时,应用水在较低温度下溶解,以增强治疗功效 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 7.1gCl2与足量的氢氧化钠溶液反应,转移的电子数一定为0.2NA | |
| B. | 标准状况下,22.4L SO3中含有氧原子数为3 NA | |
| C. | 标准状况下,18g H2O中含有氧原子数为NA | |
| D. | 5.4g 铝单质与足量NaOH溶液反应,转移电子数为0.6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com