
下列表示对应化学反应的离子方程式正确的是
A. 碳酸钙溶于醋酸:CaCO3 + 2H+ = Ca2++ CO2↑+H2O
B.苯酚钠溶液中通入少量的CO2:
C.用铜做电极电解CuSO4溶液:2Cu2++2H2O 2Cu↓+O2↑+4H+
2Cu↓+O2↑+4H+
D.用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2+ +2OH-
CH3COO-+NH4++3NH3+2Ag↓+H2O
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
下列说法不正确的是
A.乙醇和乙酸都可以与钠反应生成氢气
B.苯的硝化反应需要水浴加热
C.用溴水鉴别苯和环己烷
D.乙烯和甲烷可用酸性高锰酸钾溶液鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
绿色化学对于化学反应提出了“原子经济性”的要求。理想的原子经济性反应是原料中的原子全部转化为产物,不产生副产品,实现零排放。下列几种生产乙苯的方法中,原子经济性最好的是
 A. +C2H5Cl +HCl
A. +C2H5Cl +HCl
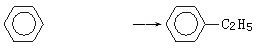 B. +C2H5OH +H2O
B. +C2H5OH +H2O
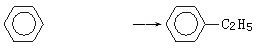 C. +CH2=CH2
C. +CH2=CH2
 D. +CH3CH3 +HCl
D. +CH3CH3 +HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
美国亚利桑那州大学(ASU)和阿贡国家实验室的科学家最近设计出生产氢气的人造树叶,原理为:
2H2O(g) 2H2(g)+O2(g)。有关该反应的说法正确的是
2H2(g)+O2(g)。有关该反应的说法正确的是
A.△H <0
B.△S <0
C.化学能转变为电能
D.氢能是理想的绿色能源
查看答案和解析>>
科目:高中化学 来源: 题型:
对羟基苯甲醛(结构简式如右图)是医药工业和香料工业的重要中间体。下列说法不正确的是
 A.能发生水解反应 B.有两种含氧官能团
A.能发生水解反应 B.有两种含氧官能团
C.与苯甲酸( )互为同分异构体
)互为同分异构体
D.一定条件下能与溴水、FeCl3溶液及银氨溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生用0.1000mol·L-1标准NaOH溶液滴定未知浓度的盐酸,其操作可分解为以下几步:
A.移取25.00mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞溶液
B.用标准NaOH溶液润洗滴定管2~3次
C.把盛有标准NaOH溶液的碱式滴定管固定好,挤压玻璃珠,使滴定管尖嘴充满溶液
D.取标准NaOH溶液注入碱式滴定管到“0”刻度以上2~3cm
E.调节液面至“0”或“0”刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定到终点,并记下滴定管液面的读数
 (1)右图中属于碱式滴定管的 ▲ (选填:“甲”、“乙”)。
(1)右图中属于碱式滴定管的 ▲ (选填:“甲”、“乙”)。
(2)正确的操作顺序是 ▲ (填字母序号)。
(3)上述B步操作的目的是 ▲ 。
(4)判断到达滴定终点的实验现象是 ▲ 。
(5)上述A步操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响是 ▲ 偏大
(填“偏大”或“偏小”或“无影响”)。
(6)若平行实验三次,记录的数据如下表
| 滴定次数 | 待测溶液的体积(/mL) | 标准NaOH溶液的体积 | |
| 滴定前读数(/mL) | 滴定后读数(/mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
试计算待测盐酸的物质的量浓度(列出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关环境保护与绿色化学的叙述不正确的是
A.形成酸雨的主要物质是硫的氧化物和氮的氧化物
B.大气污染物主要来自化石燃料燃烧和工业生产过程产生的废气
C.绿色化学的核心就是如何对被污染的环境进行无毒无害的治理
D.水华、赤潮等水体污染主要是由含氮、磷的生活污水任意排放造成的
查看答案和解析>>
科目:高中化学 来源: 题型:
N2O5是一种新型硝化剂,在一定温度下可发生下列反应: 2N2O5(g)  4NO2(g)+ O2(g) △H >0 T1温度下的部分实验数据为:
4NO2(g)+ O2(g) △H >0 T1温度下的部分实验数据为:
t/s | 0 | 500 | 1000 | 1500 |
c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是 ( )
A.500s内N2O5分解速率为2.96×10—3 mol/(L· s)
B.T1温度下的平衡常数为K1 =125,1000s时转化率为50%
C.其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,
则T1 <T2
D.T1温度下的平衡常数为K1 ,T3温度下的平衡常数为K3,若T1 >T3,则K1> K3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com