
����Ŀ���ش��������⣺
��1����ͼΪ�������ӵĽṹʾ��ͼ�����������գ�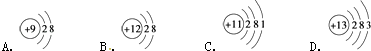
���������ӽṹ��������������ĸ��ţ���ͬ����A���ӵİ뾶B���ӵİ뾶�����������������=������
��2���л���M����̫������տ�ת����N��ת���������£� 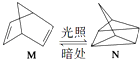 ��H=+88.6kJmol��1��M��N��ȣ����ȶ����� ��
��H=+88.6kJmol��1��M��N��ȣ����ȶ����� ��
��3����������������Ӧ����1molˮ�����ų�����241.8kJ��д���÷�Ӧ���Ȼ�ѧ����ʽΪ�� ��
��4��һ���¶�����ij���������з�����Ӧ��2A��g��+3B��g��2C��g������ʼʱ��A��Ũ��Ϊ2molL��1 �� B��Ũ��Ϊ4molL��1 �� 2min��A��Ũ�ȼ���0.8molL��1 �� ���v��B��= �� v��C��= ��
����2minĩ��C��Ũ���� �� B��Ũ���� ��
���𰸡�
��1��B����
��2��M
��3��H2��g��+ ![]() O2��g��=H2O��g����H=��241.8kJ/mol
O2��g��=H2O��g����H=��241.8kJ/mol
��4��0.6 mol?L ��1?min��1��0.4 mol?L ��1?min��1��0.8 mol/L��2.8 mol/L
���������⣺��1����Ϊ�����ӵĺ������������������������BΪ�����ӣ�A��B����Ϊ��ͬ��Ԫ�ص��������Ӳ���ͬ�����˵����Խ�뾶ԽС����B�İ뾶С��A�����Դ��ǣ�B��������2��ת�����������ȷ�Ӧ����M����������N�������ʵ�����Խ������Խ�ȶ�����˵��M�ȶ������Դ��ǣ�M����3��������������Ӧ����1molˮ��������241.8kJ���÷�Ӧ���Ȼ�ѧ����ʽΪ��H2��g��+ ![]() O2��g��=H2O��g����H=��241.8kJ/mol�� ���Դ��ǣ�H2��g��+
O2��g��=H2O��g����H=��241.8kJ/mol�� ���Դ��ǣ�H2��g��+ ![]() O2��g��=H2O��g����H=��241.8kJ/mol����4����v��A��=
O2��g��=H2O��g����H=��241.8kJ/mol����4����v��A��= ![]() =0.4molL ��1min��1 �� ��������֮�ȵ��ڻ�ѧ������֮�ȿɵã�v��B��=
=0.4molL ��1min��1 �� ��������֮�ȵ��ڻ�ѧ������֮�ȿɵã�v��B��= ![]() v��A��=
v��A��= ![]() ��0.4molL ��1min��1=0.6 molL ��1min��1��
��0.4molL ��1min��1=0.6 molL ��1min��1��
v��C��=v��A���� ![]() =0.4 molL ��1min��1��
=0.4 molL ��1min��1��
���Դ��ǣ�0.6 molL ��1min��1��0.4 molL ��1min��1��
�ڡ�c��C��=0.4 molL ��1min��1��2min=0.8mol/L����2minĩC��Ũ��Ϊ0+0.8mol/L=0.8mol/L����c��B��=2min��0.6 molL ��1min��1=1.2mol/L����2minĩB��Ũ��Ϊ4mol/L��1.2mol/L=2.8mol/L����c��C��=0.8 mol/L��c��B��=2.8 mol/L��
���Դ��ǣ�0.8 mol/L��2.8 mol/L��
�����㾫����������Ҫ�����˷�Ӧ�Ⱥ��ʱ�ͻ�ѧƽ��ļ�������֪ʶ�㣬��Ҫ�����ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�ȣ���Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%������ȷ�����⣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��T��W����Ԫ�ص����ʻ�ԭ�ӽṹ���±���
Ԫ�� | Ԫ�����ʻ�ԭ�ӽṹ |
X | ԭ�ӵ������������Ǵ�����������2�� |
Y | �����µ���Ϊ˫ԭ�ӷ��ӣ����⻯��ˮ��Һ�ʼ��� |
Z | ��̬ԭ�����������Ų�ʽΪ��n+1��sn��n+1��pn+2 |
T | ��Zͬ���ڣ�Ԫ�������+7�� |
W | ԭ������ΪY��TԪ��֮�ͣ�������к��и�Ԫ�� |
��1��Ԫ��X��һ��ͬλ�ؿɲⶨ�������������ͬλ�صķ�������WԪ�ػ�̬ԭ�ӵ����Ų�ʽΪ ��
��2��Ԫ��Z��Ԫ��T��ȣ��ǽ����Խ�ǿ��������Ԫ�ط��ű�ʾ�������б�������֤����һ��ʵ���� �� A��������Z�ĵ��ʺ�T�ĵ���״̬��ͬ
B��T���⻯���Z���⻯���ȶ�
C��һ��������Z��T�ĵ��ʶ���������������Һ��Ӧ
D��T�ĵ縺�Ա�Z��
��3�������ܼ�XZ2�ķ����У����еĦҼ���м�������Ϊ �� �����γɵľ�������Ϊ�� Y�ij����⻯����Һ������Ҫԭ����
��4������Ȼ�糣����XԪ�غ�����ĸ��κ�����T���⻯����Һ��Ӧʱ��ÿ����4.4g ���壨�����������ܽ⣩����a kJ����÷�Ӧ���Ȼ�ѧ����ʽΪ �� ��������Ӧ���������ݳ���ȡ����������Һ������pH����������ε���̼������Һ�����pH�仯������ͼ��ʾ
�������ӷ���ʽ��ʾBC�Ρ�CD�η����ķ�Ӧ��
BC����
CD�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������߷ֱ��ʾԪ�ص�ij��������˵�����Ĺ�ϵ��ZΪ�˵������YΪԪ�ص��й����ʣ���
��1�����������Ԫ���й�������������ߵı��������Ӧ�����У�a.��A��Ԫ�ص����������� ��
b.��������Ԫ�ص�����ϼ� ��
c.������������Na+��Mg2+��Al3+��P3����S2����Cl�������Ӱ뾶 ��
d.�ڶ���������Ԫ����ԭ����������ԭ�Ӱ뾶�ı仯 ��
��2�������������ʣ��� ![]() C����
C���� ![]() K����
K���� ![]() Ca����
Ca���� ![]() C����
C���� ![]() N����
N���� ![]() Ar�����У� a.��Ϊͬλ�ص��� ��
Ar�����У� a.��Ϊͬλ�ص��� ��
b.��������ȣ������ܻ���ͬλ�ص��� ��
c.��������ȣ�������������ȵ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����ظ����ƣ�Na2Cr2O7���ᾧ���ĸҺ������������Fe3+�������ظ���أ�K2Cr2O7�����������̼���������ܽ��������ͼ��
��1����Na2Cr2O7����K2Cr2O7�Ļ�ѧ����ʽΪ �� ͨ����ȴ�ᾧ��������K2Cr2O7��ԭ���� ��
��2����Na2Cr2O7ĸҺ�мӼ�Һ��pH��Ŀ���� ��
��3������A��ҪΪ���ѧʽ��������B��ҪΪ���ѧʽ����
��4������ˮϴ�ӹ���A�����յ�ϴ��Һת�Ƶ�ĸҺ��������У�������߲����ֿ�ʹ�ܺ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����I����ˮ��Һ�гȺ�ɫ��Cr2O72--���ɫ��CrO42--������ƽ���ϵ��Cr2O72--+H 2O![]() 2CrO42--+2H���ֽ�һ������K2Cr2O7����ˮ���ϡ��Һ����Һ�ʳ�ɫ��
2CrO42--+2H���ֽ�һ������K2Cr2O7����ˮ���ϡ��Һ����Һ�ʳ�ɫ��
��1����������Һ�м���Ũ������Һ����Һ��__________ɫ����Ϊ_____________________��
��2����ԭ��Һ�м���Ba(NO3)2��Һ����֪BaCrO4Ϊ��ɫ����������ƽ����__________�����ƶ�(������)����Һ��ɫ��__________��������dz����
��II����ҵ����һ����CO2�����״�ȼ�ϵķ���:
CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g) ��H����49.0 kJ/mol
CH3OH(g)��H2O(g) ��H����49.0 kJ/mol
ijʵ���н�6 mol CO2��8 mol H2����2 L���ܱ������У����H2�����ʵ�����ʱ��仯��ͼ���� (��)��ʾ��������������⣺
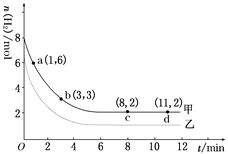
��1��a������Ӧ����________�淴Ӧ����(����>������<����������)��
��2�������ı�ijһʵ�������ٽ���һ��ʵ�飬���H2�����ʵ�����ʱ��仯��ͼ������(��)��ʾ������(��)��Ӧ�ı��ʵ������������________(�����)��
a���Ӵ��� b������ѹǿ c�������¶� d������H2Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ��������ѧ�����ϵ�һ���ش�ͻ�ƣ��䷴Ӧԭ��ΪN2��g��+3H2��g��2NH3��g����H=��92.4kJmol��1 �� һ�ֹ�ҵ�ϳɰ��ļ�ʽ����ͼ���£�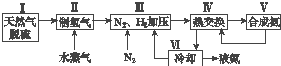
��1����Ȼ���е�H2S���ʳ��ð�ˮ���գ�����ΪNH4HS��һ����������NH4HS��Һ��ͨ��������õ�������ʹ����Һ������д��������Ӧ�Ļ�ѧ����ʽ��
��2�����������������ԭ�����£���CH4��g��+H2O��g��CO��g��+3H2��g����H=+206.4 kJmol��1
��CO��g��+H2O��g��CO2��g��+H2��g����H=��41.2kJmol��1
���ڷ�Ӧ�٣�һ���������ƽ����ϵ��H2�İٷֺ��������ܼӿ췴Ӧ���ʵĴ�ʩ�� ��
a�������¶�b������ˮ����Ũ�� c���������d������ѹǿ
���÷�Ӧ�ڣ���CO��һ��ת���������H2�IJ�������1mol CO��H2�Ļ�����壨CO���������Ϊ20%����H2O��Ӧ���õ�1.18mol CO��CO2��H2�Ļ�����壬��CO��ת����Ϊ ��
��3��ͼ��a����ʾ500�桢60.0MPa�����£�ԭ����Ͷ�ϱ���ƽ��ʱNH3��������Ĺ�ϵ������ͼ��a�����ݼ���N2��ƽ����������� ��
��4�������¶ȶԺϳɰ���Ӧ��Ӱ�죬��ͼ��b������ϵ�У�����һ�������µ��ܱ������ڣ���ͨ��ԭ������ʼ�����¶Ȳ������ߣ�NH3���ʵ����仯������ʾ��ͼ �� 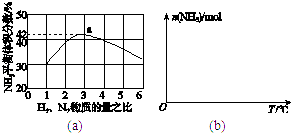
��5����������ͼ�У�ʹ�ϳɰ��ų��������õ�������õ���Ҫ�����ǣ�����ţ� �� ��������������ߺϳɰ�ԭ����ת���ʵķ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A��G����ͼ��ʾת����ϵ������������û���г���������A�dz����Ľ������ʣ�E��F�����壮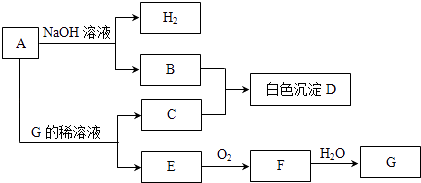
��ش��������⣺
��1��д���������ʵĻ�ѧʽ��A��D��G��
��2��B��C��Ӧ����D�����ӷ���ʽΪ��
��3��A�ڼ�����Һ�к�NO3����Ӧʱ����B��NH3 �� �ܷ�Ӧ�����ӷ���ʽΪ��
��4����ͬ�����£���500mLE��F�Ļ��������ͨ��187.5mLO2 �� ���������ǡ����ȫ��ˮ��������G����E��F�������Ϊ ��
��5���������E��Fͨ��NaOH��Һ�п������κ�ˮ����Ӧ�Ļ�ѧ����ʽΪ �� �����£�0.1mol/L����������ҺpH=8.3��ԭ���ǣ������ӷ���ʽ��ʾ������Һ���������Ӱ�Ũ���ɴ�С���е�˳��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������˳����ȷ����( )
A. ���ȶ��ԣ�H2O>NH3>PH3
B. ԭ�Ӱ뾶��Si>Na>O
C. ������ CsOH>KOH>NaOH
D. ʧ����������K>Na>Mg
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com