
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( ) 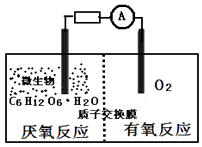
A.负极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从正极区移向负极区
D.电池总反应为C6H12O6+6O2═6CO2+6H2O
【答案】C
【解析】解:A.根据图知,负极上C6H12O6失电子,正极上O2得电子和H+反应生成水,负极的电极反应式为C6H12O6+6H2O﹣24e﹣=6CO2+24H+,正极的电极反应式为O2+4e﹣+4H+═2H2O,因此CO2在负极产生,故A正确;
B.葡萄糖在微生物的作用下将化学能转化为电能,形成原电池,有电流产生,所以微生物促进了反应中电子的转移,故B正确;
C.通过原电池的电极反应可知,负极区产生了H+,根据原电池中阳离子向正极移动,可知质子(H+)通过交换膜从负极区移向正极区,故C错误;
D.该反应属于燃料电池,燃料电池的电池反应式和燃烧反应式相同,则电池反应式为C6H12O6+6O2=6CO2+6H2O,故D正确;
故选C.
A.根据图知,负极上C6H12O6失电子,正极上O2得电子和H+反应生成水,负极的电极反应式为C6H12O6+6H2O﹣24e﹣=6CO2+24H+,正极的电极反应式为O2+4e﹣+4H+═2H2O;
B.葡萄糖在微生物的作用下将化学能转化为电能,形成原电池;
C.原电池中,阳离子向正极移动,所以质子通过交换膜从负极区移向正极区;
D.燃料电池反应式和燃料燃烧方程式相同.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】纳米级Cu2O是优良的催化剂和半导体材料,工业上常用下列方法制备Cu2O。
(1)热还原法
加热条件下,用液态肼(N2H4)还原新制的Cu(OH)2制备Cu2O,同时放出N2。该反应的化学方程式为。
(2)电解法 以氢氧燃料电池为电源,用电解法制备Cu2O的装置如图。
①A的化学式为。
②燃料电池中,OH-的移动方向为(填“由左向右”或“由右向左”);电解池中,阳极的电极反应式为。
③电解一段时间后,欲使阴极室溶液恢复原来组成,应向其中补充一定量 (填化学式)。
④制备过程中,可循环利用的物质为(填化学式)。
(3)干法还原法
利用反应Cu +CuO ![]() Cu2O制备Cu2O。将反应后的均匀固体混合物(含有三种成分)等分为两份,一份与足量H2充分反应后,固体质量减少6.4g;另一份恰好溶于500mL稀硝酸,生成标准状况下4.48LNO,该稀硝酸的物质的量浓度为。
Cu2O制备Cu2O。将反应后的均匀固体混合物(含有三种成分)等分为两份,一份与足量H2充分反应后,固体质量减少6.4g;另一份恰好溶于500mL稀硝酸,生成标准状况下4.48LNO,该稀硝酸的物质的量浓度为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是 ( )
A.K+ H+ SO42- OH-B.Na+ CO32﹣ Ca2+ NO3-
C.Na+ H+ Cl- CO32﹣D.Na+ Cl- SO42- H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽.接通电路后发现B上的c点显红色.为实现铁上镀锌,接通K后,使c、d两点短路.下列叙述正确的是( ) 
A.a为直流电源的负极
B.c极发生的反应为2H++2e﹣═H2↑
C.f电极为锌板
D.e极发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下图所列仪器组装为一套实验室蒸馏石油的装置,并进行蒸馏,得到汽油和煤油。
(三) | (一) | (五) |
|
|
|
(二) | (六) | (四) |
|
|
|
(1)图中A、B、C三种仪器的名称分别是。
(2)将以上仪器按(一)~(六)顺序,用字母a,b,c…表示连接顺序:
e接;接;接;接;接。
(3)A仪器中c口是 , d口是(填“进水口”或“出水口”)。
(4)蒸馏时,温度计水银球应在位置。
(5)在B中注入原油后,加几片碎瓷片的目的是。
(6)给B加热,收集到沸点60~150℃间的馏分是 , 收集到150~300℃间的馏分是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业中电解饱和食盐水的原理如图所示.下列说法不正确的是( )
A.溶液A的溶质是NaOH
B.阴极附近溶液pH升高
C.气体a为氯气,其电极反应为2Cl﹣﹣2e﹣═Cl2↑
D.与产生气体b的电极相连的是电源的正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com