
【题目】合金在生活、生产、国防等领域有广泛应用。镍是重要的合金元素,例如镧镍合金、白铜(铜镍合金)、铝镍合金等。
(1)基态镍原子的外围电子排布式为_____________。
(2)在NiSO4溶液中滴加稀氨水能形成配位化合物[Ni(NH3)4]SO4。
①H、N、O、Ni的电负性大小顺序为______________________。
②与SO42—互为等电子体的分子(写出一种即可)______________。
③SO32—、SO42—中S的杂化类型都是___________;但它们的实际空间构型却不同,其主要原因是________________________________________________________________。
(3)工业上,采用反应Ni(s)+4CO(g)![]() Ni(CO)4(g)提纯粗镍。推测Ni(CO)4晶体中存在的作用力有__________。
Ni(CO)4(g)提纯粗镍。推测Ni(CO)4晶体中存在的作用力有__________。
a、范德华力 b、配位键 c、非极性键 d、极性键 e、离子键
(4)镧镍合金的晶胞如图1所示,镍原子除了1个在体心外,其余都在面上。该合金中镍原子和镧原子的个数比为________。
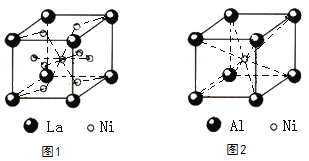
(5)铝镍合金的晶胞如图2所示。已知:铝镍合金的密度为ρg/cm3,NA代表阿伏加德罗常数的数值,则镍、铝的最短核间距(d)为________________pm。
【答案】 3d84s2 O>N>H>Ni CCl4 sp3杂化 SO32—中S原子价层有1个孤电子对,而SO42—中S原子价层没有孤电子对 a、b、d 5:1 ![]()
【解析】(1). 镍是28号元素,基态镍原子的外围电子排布式为3d84s2,故答案为:3d84s2;
(2). ①.因非金属性O>N>H>Ni,所以H、N、O、Ni的电负性大小顺序为O>N>H>Ni,故答案为:O>N>H>Ni;
②.含有的原子数和价电子数相等的微粒互为等电子体,则与SO42-互为等电子体的分子有CCl4等,故答案为:CCl4;
③. SO32-、SO42-中S原子的价层电子对数均为4,所以S原子的杂化类型都是sp3杂化,因 SO32-中S原子价层有1个孤电子对,而 SO42-中S原子价层没有孤电子对,所以造成它们的实际空间构型不同,故答案为:sp3杂化;SO32-中S原子价层有1个孤电子对,而SO42-中S原子价层没有孤电子对;
(3). Ni(CO)4是分子晶体,分子晶体之间存在范德华力,Ni与C原子之间存在配位键,C与O原子之间存在极性键,故答案为:a、b、d;
(4). 据图可知,镧原子位于立方晶胞的顶点,镧原子有8×![]() =1个,镍原子除了1个在体心外,其余都在面上,镍原子有8×
=1个,镍原子除了1个在体心外,其余都在面上,镍原子有8×![]() +1=5个,所以该合金中镍原子和镧原子的个数比为5:1,故答案为:5:1;
+1=5个,所以该合金中镍原子和镧原子的个数比为5:1,故答案为:5:1;
(5). 据图可知,该晶胞中含有Al原子个数为8×![]() =1个,Ni原子个数为1个,设晶胞边长为acm,则铝镍合金的密度为ρ=
=1个,Ni原子个数为1个,设晶胞边长为acm,则铝镍合金的密度为ρ=![]() g/cm3,a=
g/cm3,a=![]() cm,Ni原子位于体心,Al原子位于顶点,则镍、铝的最短核间距(d)为体对角线的一半,即d=
cm,Ni原子位于体心,Al原子位于顶点,则镍、铝的最短核间距(d)为体对角线的一半,即d=![]() ×1010pm,故答案为:
×1010pm,故答案为:![]() ×1010。
×1010。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】已知: A 用于医疗消毒, C 为常用调味品; E 与 B 都能发生银镜反应, E 的相对分子质量比 B 大 12,请回答:
(1)求 E 的结构简式_______;乙生成聚合物的反应类型_______。
(2)C 生成甲的方程式_______。
(3)下列说法不正确的是________。
A. 物质 A 与金属钠反应比水与金属钠反应要剧烈
B. 用蒸馏的方法分离物质 A 与 C 可得到纯净的 A
C. 根据溴水褪色现象,可以证明物质 E 中一定存在碳碳双键
D.新制碱性氢氧化铜悬浊液可鉴别物质 A、 B 和 C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 气体摩尔体积是指1 mol任何气体占有的体积都约是22.4 L
B. 1 L一氧化碳气体一定比1 L氧气的质量小
C. 在常温、常压下,11.2 L N2含有的分子数是0.5NA
D. 32 g O2在标准状况下的体积约是22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( )


A. ①是其他条件一定时,反应速率随温度变化的图像,正反应ΔH<0
B. ②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像
C. ③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线
D. ④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中对离子方程式的评价合理的是
选项 | 化学反应及其离子方程式 | 评价 |
A | H2SO4溶液与Ba(OH)2溶液反应: H++ SO42-+Ba2++OH | 正确 |
B | 向碳酸镁浊液中加入足量稀盐酸: CO32-+2H+ | 错误,碳酸镁不应写成离子形式 |
C | 向沸水中滴加饱和的氯化铁溶液至液体变为红褐色:Fe3++3H2O | 正确 |
D | 向NaOH溶液中通入少量CO2反应:OH+CO2 | 正确 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某河道两旁有甲、乙两厂,它们排放的工业废水中共含K+、Ag+、Fe3+、Cl-、OH-、NO![]() 六种离子。
六种离子。
(1)甲厂的废水含有OH-,则甲厂废水中一定不含_______和________(填离子符号)。
(2)乙厂的废水中一定含有的阴离子是________(填离子符号),加入铁粉后可回收某种金属,写出该反应的离子方程式:__________________________。
(3)另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的某些离子转化为沉淀。经过滤后的废水主要含________(写化学式),可用来浇灌农田。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NO2装入带有活塞的密闭容器中,当反应2NO2(g)![]() N2O4(g)达到平衡后,改变下列一个条件,下列叙述正确的是
N2O4(g)达到平衡后,改变下列一个条件,下列叙述正确的是
A. 升高温度,气体颜色加深,则此反应为吸热反应
B. 慢慢压缩气体体积,平衡向正反应方向移动,混合气体的颜色变浅
C. 慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D. 恒温恒容时,充入稀有气体,压强增大,平衡向正反应方向移动,混合气体的颜色变浅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com