
【题目】NA代表阿伏加德罗常数,下列说法正确的是
A. 1L1mol/LMgCl2溶液中含有的Mg2+离子数为NA
B. 100 mL 2.0 mol/L的盐酸与醋酸溶液中氢离子均为0.2NA
C. 0.1mol/L稀硫酸中含SO42- 的数目为0.1NA
D. 标准状况下,11.2LNO和5.6LO2混合后,分子总数小于0.5NA
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 银锌纽扣电池的放电反应:Zn+Ag2O+H2O=Zn(OH)2+2Ag,其中Ag2O作正极,发生还原反应
B. 通过构成原电池,能将反应的化学能全部转化为电能
C. 如图原电池中,电池工作时,SO42-移向电池的正极
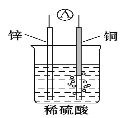
D. 构成原电池的两个电极必须是活泼性不同的两种金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如下图所示。下列说法正确的是
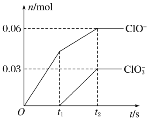
A. 苛性钾溶液中KOH的物质的量是0.09 mol
B. ClO3-的生成是由氯气的量的多少引起的
C. 在酸性条件下ClO-和ClO3-可生成Cl2
D. 反应中转移电子的物质的量是0.21 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中Z单质与H2混合遇强光会发生爆炸。则下列判断错误的是

A.气态氢化物的沸点:H2T>H2Y>H2R
B.R与Y的电子数相差8
C.非金属性:Z>Y>X
D.Z的含氧酸的酸性比Y的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭系统中有反应C(s)+CO2(g) ![]() 2CO(g),能使反应速率加快的措施是
2CO(g),能使反应速率加快的措施是
①通过减小容器体积增大压强 ②升高温度 ③将炭粉碎 ④通入CO2 ⑤增加炭的量 ⑥恒容条件下通入N2使得压强增大
A. ①②③⑥B. ①②④⑥C. ①②③④D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,可用离子方程式![]() +2H+=CO2↑+H2O表示的是( )
+2H+=CO2↑+H2O表示的是( )
A.碳酸钙和足量盐酸的反应B.碳酸钠溶液与氯化钙溶液的反应
C.碳酸钠溶液与足量稀硝酸反应D.碳酸钡和足量硫酸的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、D、E、G、M、L六种前四周期的元素。A是宇宙中最丰富的元素。D原子核外有1个未成对电子,D+比E原子少1个电子层,E原子得1个电子填入3p轨道后,3p轨道呈全充满状态。G原子的2p轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G原子序数相差8。L位于周期表第12纵行且是六种元素中原子序数最大的。R是由M、L形成的化合物,其晶胞结构如下图所示。
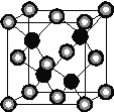
请回答下列问题:
(1)E元素的电负性________(填“>”“<”或“=”)M元素的电负性。
(2)G的第一电离能比它同周期前一族相邻元素的第一电离能________(填“大”或“小”)。
(3)M2E2广泛用于橡胶工业,在该化合物分子中,所有原子最外层均满足8电子稳定结构。则在M2E2分子中M原子的杂化类型是___,M2E2是____(填“极性”或“非极性”)分子。
(4)L的价电子排布式为________,该元素位于周期表中的________族。
(5)R的化学式为____________(用元素符号表示),属于________晶体。已知R晶体的密度为ρg·cm-3,则该晶胞的边长a________cm。(阿伏伽德常数用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以工业生产硼砂所得废渣硼镁泥为原料制取MgSO4·7H2O的过程如图所示:

硼镁泥的主要成分如下表:
MgO | SiO2 | FeO、Fe2O3 | CaO | Al2O3 | B2O3 |
30%~40% | 20%~25% | 5%~15% | 2%~3% | 1%~2% | 1%~2% |
回答下列问题:
(1)“酸解”时应该加入的酸是_______,“滤渣1”中主要含有_________(写化学式)。
(2)“除杂”时加入次氯酸钙、氧化镁的作用分别是________、_______。
(3)判断“除杂”基本完成的检验方法是____________。
(4)分离滤渣3应趁热过滤的原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2 mol·L-1的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是

A. HA为强酸
B. 该混合液pH=7
C. 图中X表示HA,Y表示OH-,Z表示H+
D. 该混合溶液中:c(A-)+c(Y)=0.1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com