
某无色溶液由Na+、Ag+、Ba2+、Al3+、
[Al(OH)4]-、MnO4-、CO32-、SO42-中的若干种组成。取该溶液进行如下实验:
(A)取试液适量,加入过量稀盐酸,有气体生成,得到溶液甲
(B)向溶液甲中再加入过量碳酸氢铵溶液,有气体生成,析出白色沉淀乙,得到溶液丙
(C)向溶液丙中加入过量Ba(OH)2溶液,有气体生成,析出白色沉淀丁。
根据上述实验回答下列问题:
(1)溶液中一定不存在的离子是________________________________________。
(2)一定存在的离子是________________________________________________。
(3)生成沉淀乙的离子反应方程式是____________________________________。
(4)写出步骤(C)中产生气体的离子方程式_______________________________。
题目中根据“无色”,确定一定没有MnO4-,若Ag+存在,则CO32-、
SO42-不能存在;若Ba2+存在,则CO32-、SO42-不能存在;若Al3+存在,则CO32-、[Al(OH)4]-不能存在。当加入过量盐酸时,溶液中可以与H+反应的离子有
CO32- (有气体生成)、[Al(OH)4]-(无明显现象,但生成Al3+),可以与盐酸电离产生的Cl-发生反应的是Ag+(有白色沉淀生成),根据 现象可以确定原溶液中一定有CO32- (则无Al3+和Ba2+),一定无Ag+。在甲溶液中加入碳酸氢铵后得到沉淀说明甲溶液中有Al3+,与HCO3-发生水解相互促进反应生成二氧化碳气体和氢氧化铝沉淀,因此确定原溶液中有[Al(OH)4]-。当继续在溶液中加入过量氢氧化钡溶液时,则属于碱中的OH-与HCO3-反应生成的CO32-与Ba2+反应得到碳酸钡沉淀,因此不
现象可以确定原溶液中一定有CO32- (则无Al3+和Ba2+),一定无Ag+。在甲溶液中加入碳酸氢铵后得到沉淀说明甲溶液中有Al3+,与HCO3-发生水解相互促进反应生成二氧化碳气体和氢氧化铝沉淀,因此确定原溶液中有[Al(OH)4]-。当继续在溶液中加入过量氢氧化钡溶液时,则属于碱中的OH-与HCO3-反应生成的CO32-与Ba2+反应得到碳酸钡沉淀,因此不 能误认为是硫酸钡而确定存在SO42-,而生成的气体则为铵根阳离子与氢氧根离子反应得到的氨气。
能误认为是硫酸钡而确定存在SO42-,而生成的气体则为铵根阳离子与氢氧根离子反应得到的氨气。
答案:(1)Al3+、Ba2+、Ag+、MnO4-
(2)Na+、[Al(OH)4]-、CO32-
(3)Al3++3HCO-====3Al(OH)3↓+3CO2↑
(4)OH-+NH4+====NH3↑+H2O


科目:高中化学 来源: 题型:
在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是( )
A.正极附近的SO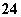 离子浓度逐渐增大
离子浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极有O2逸出
D.铜片上有H2逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g) CH3OH(g),以下说法正确的是( )
CH3OH(g),以下说法正确的是( )
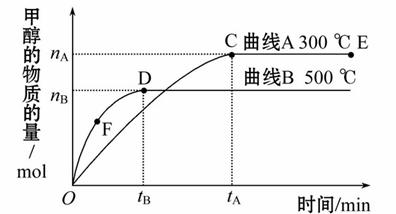
A.E点的平衡常数大于D点的平衡常数,且该反应的ΔH>0
B.容器中气体的总物质的量E点大于D点
C.F点的正反应速率大于逆反应速率
D.v(甲醇)表示500 ℃时以上反应在D点的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中正确的是( )
A.澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+====Ca2++2H2O
B.钠与水的反应:Na+2H2O====Na++2OH-+H2↑
C.铜片插入硝酸银溶液中:Cu+Ag+====Cu2++Ag
D.大理石溶于醋酸的反应:CaCO3+2CH3COOH====Ca2++2CH3COO-+CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
pH相同的盐酸溶液与醋酸溶液分别和锌粒反应,若最后锌都已完全溶解,放出的气体一样多,下列说法正确的是( )
A.反应所需时间:醋酸>盐酸
B.整个反应阶段的平均反应速率:醋酸>盐酸
C.开始的反应速率:盐酸>醋酸
D.参加反应的锌的质量:盐酸=醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是
( )
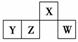
A.原子半径:rW>rZ>rY>rX
B.含Y元素的盐溶液有的显酸性,有的显碱性
C.气态氢化物的热稳定性:Z>W
D.X与H、O元素形成的化合物一定是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为14;X原子的内层电子数与Y原子的最外层电子数相等;X原子的核外电子总数与Z原子的最外层电子数相等。下列说法正确的是( )
A.X的氧化物都能与水反应生成酸
B.Y和Z组成的化合物是离子化合物
C.Z的离子半径比Y的离子半径小
D.X的气态氢化物分子与Z的离子具有相同的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇是人们开发利用的一种新能源,已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.8 kJ·mol-1
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH2=-192.9 kJ·mol-1
③CH3OH(l)===CH3OH(g) ΔH3=+37.4 kJ·mol-1
(1)写出表示甲醇燃烧热的热化学方程式:__________________________________________________________
__________________________________________________________。
(2)H2的燃烧热为__________________________________________________________。
(3)二甲醚也是一种新型燃料,1 mol二甲醚蒸气完全燃烧生成CO2和液态水时放出1 455 kJ热量,若1 mol二甲醚和甲醇的混合气体完全燃烧生成CO2和液态水时共放出1 224.9 kJ热量,则混合气体中甲醇和二甲醚的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列框图中每个字母表示一种反应物或生成物,其中A、B、E为气体,A在B中燃烧时发生苍白色火焰,反应③为实验室制取氧气的常用反应之一.请按下述框图进行推断(其中一部分生成物已略去):
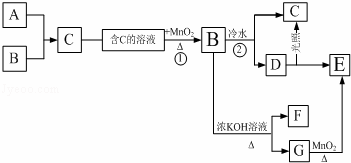
(1)写出A、B、F、G的化学式:
A ;B ;F ;G .
(2)写出反应①的离子反应方程式 .根据框图的先后,两处MnO2的作用依次是 剂、 剂.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com