

 ),可以使用的仪器分析方法是质谱法或核磁共振氢谱.
),可以使用的仪器分析方法是质谱法或核磁共振氢谱. 分析 (1)依据乙酸酐易水解分析;
(2)抽滤操作,需用到烧杯、玻璃棒、安全瓶、布氏漏斗和抽滤瓶等仪器;
(3)酸能和碳酸氢钠反应生成CO2气体,故滴加NaHCO3溶液不再产生气泡时可以说明溶液接近中性;缓慢滴加是防止反应速率太快;
(4)不同物质在扩散剂中扩散的速率不同;
(5)得到纯净的针状晶体乙酰基二茂铁并回收乙醚,应进行蒸馏;乙醚沸点较低,应用水浴加热;
(6)可用质谱法或核磁共振氢谱确定有机物的结构.
解答 解:(1)由于乙酸酐极易水解,故合成过程中要求无水操作,防止乙酸酐水解;
故答案为:防止乙酸酐水解;
(2)抽滤操作,需用到烧杯、玻璃棒、安全瓶、布氏漏斗和抽滤瓶等仪器,
故答案为:布氏漏斗、抽滤瓶;
(3)酸能和碳酸氢钠反应生成CO2气体,故滴加NaHCO3溶液不再产生气泡时可以说明溶液接近中性;
缓慢滴加是防止产生CO2速率太快,将液体冲出烧杯;
故答案为:滴加NaHCO3溶液不再产生气泡;防止产生CO2速率太快,将液体冲出烧杯;
(4)不同物质在扩散剂中扩散的速率不同,故可以使用层析法进行分离,
故答案为:不同物质在扩散剂中扩散的速率不同;
(5)由于有机物之间的溶解性大,但沸点相差较大,所以X的操作名称应该是蒸馏;
乙醚沸点较低,故应用水浴加热,
故答案为:蒸馏;水浴加热;
(6)由于乙酰基二茂铁和二乙酰基二茂铁的结构不同,相对分子质量不同,但都含有相同的官能团,所以可以使用的仪器分析方法是质谱法或核磁共振氢谱,
故答案为:质谱法或核磁共振氢谱.
点评 本题以乙酰基二茂铁为载体考查化学基本实验操作、仪器的选择、物质的分离和提纯以及有机物结构的鉴别,是高考中的常见考点和题型,难度中等.侧重考查学生灵活运用基础知识解决实际问题的能力.


 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:填空题
 $\stackrel{NaHCO_{3}溶液}{→}$X$\stackrel{NaOH溶液}{→}$Y$\stackrel{CO_{2}}{→}$Z$\stackrel{HCl}{→}$M$→_{浓H_{2}SO_{4}△}^{CH_{3}OH酯化}$N
$\stackrel{NaHCO_{3}溶液}{→}$X$\stackrel{NaOH溶液}{→}$Y$\stackrel{CO_{2}}{→}$Z$\stackrel{HCl}{→}$M$→_{浓H_{2}SO_{4}△}^{CH_{3}OH酯化}$N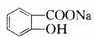 ,Y
,Y ,Z
,Z ,M
,M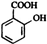 ,N
,N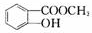 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 金属性:Z>Y | |
| B. | 气态氢化物的稳定性:M>N | |
| C. | X和Y形成的化合物中可能含共价键 | |
| D. | Z元素的离子半径是本周期元素离子半径最小的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| 取适量铁钉与稀硫酸浸泡后的溶液于试管中,依次滴入适量的氯水和几滴KSCN溶液,振荡. | 溶液呈血红色 | 乙同学的观点正确 (填“正确”或“错误”). |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验题(一)在实验室配制100mL0.5mol/L的Na2CO3溶液,请回答下列问题
实验题(一)在实验室配制100mL0.5mol/L的Na2CO3溶液,请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 min末时A和B的浓度之比为5:3 | |
| B. | x=1 | |
| C. | 2 min末时B的浓度为1.5 mol•L-1 | |
| D. | 前2 min,A的消耗浓度为0.5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8NH3(g)+6NO2(g)═7N2(g)+12H2O(g)△H<0,则该反应一定能自发进行 | |
| B. | 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 | |
| C. | 催化剂可以加快化学反应速率,也能增大化学反应的焓变 | |
| D. | NH3•H2O溶液加水稀释后,溶液中Kw的值增大. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com