
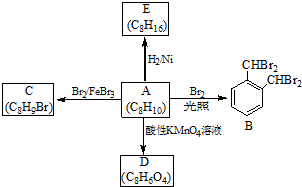
 ;
;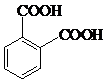 .
. 分析 A和溴发生取代反应生成B,根据B的结构简式知,A为邻二甲苯,其结构简式为 ,A和溴在催化剂条件下发生取代反应生成C,根据C的分子式知,C的结构简式为
,A和溴在催化剂条件下发生取代反应生成C,根据C的分子式知,C的结构简式为 等,A被酸性高锰酸钾氧化生成D对二苯甲酸,其结构简式为
等,A被酸性高锰酸钾氧化生成D对二苯甲酸,其结构简式为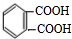 ,A与氢气发生加成反应生成E为
,A与氢气发生加成反应生成E为 ,据此解答.
,据此解答.
解答 解:A和溴发生取代反应生成B,根据B的结构简式知,A为邻二甲苯,其结构简式为 ,A和溴在催化剂条件下发生取代反应生成C,根据C的分子式知,C的结构简式为
,A和溴在催化剂条件下发生取代反应生成C,根据C的分子式知,C的结构简式为 等,A被酸性高锰酸钾氧化生成D对二苯甲酸,其结构简式为
等,A被酸性高锰酸钾氧化生成D对二苯甲酸,其结构简式为 ,A与氢气发生加成反应生成E为
,A与氢气发生加成反应生成E为 ,
,
(1)A为 ,其名称是邻二甲苯(或1,2-二甲基苯),故答案为:邻二甲苯(或1,2-二甲基苯);
,其名称是邻二甲苯(或1,2-二甲基苯),故答案为:邻二甲苯(或1,2-二甲基苯);
(2)根据分子式变化知,A生成B的反应为取代反应,故答案为:取代;
(3)A为 ,C为
,C为 等,A和溴发生取代反应生成C,反应方程式为
等,A和溴发生取代反应生成C,反应方程式为 ,
,
故答案为: ;
;
(4)A为 ,A中甲基被酸性高锰酸钾溶液氧化生成羧基,所以D的结构简式为
,A中甲基被酸性高锰酸钾溶液氧化生成羧基,所以D的结构简式为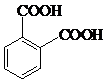 ,故答案为:
,故答案为: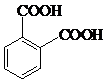 .
.
点评 本题考查有机物推断,侧重考查学生分析推断能力,为高频考点,以B结构简式为突破口结合反应条件进行推断,熟悉常见有机反应类型及反应条件,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | C6H5CH2Cl+NaCN-→C6H5CH2CN+NaCl | B. | 2Na+2 C2H5OH-→2C2H5ONa+H2↑ | ||
| C. | CH3CH2CHO+HCN-→CH3CH2CH(CN)OH | D. | CH3COOC2H5+H2O-→CH3COOH+C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
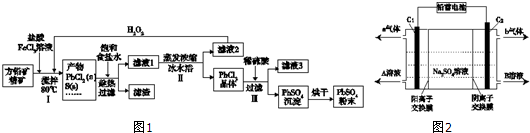
| Ksp | 开始沉淀时pH | 完全沉淀时pH | ||
| PbSO4 | 1.08×10-8 | Fe (OH)3 | 2.7 | 3.7 |
| PbCl2 | 1.6×10-5 | Pb( OH)2 | 6 | 7.04 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其水溶液显弱酸性,俗称石炭酸 | |
| B. | 其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗 | |
| C. | 其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶 | |
| D. | 苯酚溶液不能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1,3-丁二烯的1,2-加成:H2C=CHCH=CH2+Cl2→CH2ClCH=CHCH2Cl | |
| B. | 甲苯和氯气光照条件下发生反应: | |
| C. | 用醋酸去除水垢:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | 用银氨溶液检验乙醛的醛基:CH3CHO+2Ag(NH4)2OH$\stackrel{水浴加热}{→}$CH3COONH4+3NH3+2Ag↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N、O、F的原子半径依次增大 | B. | H2O、NH3、PH3的热稳定性依次增强 | ||
| C. | HCl、HBr、HI的还原性依次减弱 | D. | LiOH、KOH、CsOH的碱性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 依据原子序数,推断该元素原子的核外电子数 | |
| B. | 依据相对分子质量,推断物质常温下的溶解度 | |
| C. | 依据气体的摩尔质量,推断相同状况下不同气体密度的大小 | |
| D. | 依据元素原子的最外层电子数,推测其可能的最高正价和最低化合价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2 和D2 互为同位素 | |
| B. | 40Ca和40K中质子数和中子数都不相等 | |
| C. | 只含一种元素的物质一定是纯净物 | |
| D. | 18O中中子数和质子数相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com