
分析 根据n=$\frac{m}{M}$计算Zn的物质的量,再根据Zn+H2SO4=ZnSO4+H2↑计算生成氢气、硫酸锌的物质的量.
(1)根据V=nVm计算氢气体积;
(2)根据c=$\frac{n}{V}$计算所得溶液中硫酸锌的物质的量浓度.
解答 解:6.5g Zn的物质的量为$\frac{6.5g}{65g/mol}$=0.1mol
设生成硫酸锌、氢气的物质的量分别为x、y,则:
Zn+H2SO4=ZnSO4+H2↑
1 1 1
0.1mol x y
所以x=y=$\frac{0.1mol×1}{1}$=0.1mol
(1)标况下生成氢气体积为:0.1mol×22.4L/mol=2.24L,
答:标况下生成氢气2.24L.
(2)所得溶液中硫酸锌的物质的量浓度为$\frac{0.1mol}{0.08L}$=1.25mol/L,
答:所得溶液中硫酸锌的物质的量浓度为1.25mol/L.
点评 本题考查化学方程式计算、物质的量有关计算,比较基础,有利于基础知识巩固.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的熔沸点随着原子序数的增加而升高 | |
| B. | 碱金属单质与水剧烈反应生成碱和氢气 | |
| C. | 单质在空气中燃烧生成的都是过氧化物 | |
| D. | 都是银白色的软金属,密度都较小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
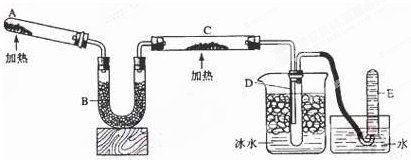
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al能溶于氯化铵溶液中且放出氢气 | |
| B. | Al、Al2O3、Al(OH)3都可溶于盐酸和氢氧化钠溶液中 | |
| C. | Al(OH)3能和NaOH溶液反应,也能与氨水反应 | |
| D. | 向Al2(SO4)3溶液中滴加过量氨水,可得白色沉淀,加入过量NaHSO4溶液沉淀消失 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com