
【题目】已知:
①I2(g)+H2(g)![]() 2HI(g) ΔH1=-9.48 kJ/mol
2HI(g) ΔH1=-9.48 kJ/mol
②I2(s)+H2(g)![]() 2HI(g) ΔH2=+26.48 kJ/mol
2HI(g) ΔH2=+26.48 kJ/mol
下列判断正确的是( )
A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B.I2(g)=I2(s) ΔH=-17.00 kJ/mol
C.固态碘的稳定性比气态碘的稳定性高
D.1 mol固态碘和1 mol气态碘分别与氢气完全反应,前者断裂的I—I键更多
【答案】C
【解析】
A. 254 g I2(g)和2 g H2(g)的物质的量均为1mol,由I2(g)+H2(g)![]() 2HI(g) ΔH1=-9.48 kJ/mol可知,若这些反应物完全转化为生成物,则可放热9.48 kJ,由于该反应是可逆反应,反应物不能转化为生成物,反应放热少于9.48 kJ, A项错误;
2HI(g) ΔH1=-9.48 kJ/mol可知,若这些反应物完全转化为生成物,则可放热9.48 kJ,由于该反应是可逆反应,反应物不能转化为生成物,反应放热少于9.48 kJ, A项错误;
B.根据盖斯定律,①-②得:I2(g)=I2(s) ΔH=-35.96 kJ/mol,B项错误;
C. 由上述热化学方程式可知,在相同条件下,固态碘能量低于气态碘,故固态碘的稳定性比气态碘的稳定性高,C项正确;
D. 1 mol固态碘和1 mol气态碘均含有1 mol I—I键,分别与氢气完全反应,两者断裂的I—I键相同,D项错误。
故选C。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】
铜矿( CuFeS2)是炼铜的最主要矿物。火法冶炼黄钢矿的过程中,其中一步反应是:2Cu2O+Cu2S![]() 6Cu+SO2。回答下列问题。
6Cu+SO2。回答下列问题。
(1)Cu+价电子的电子排布图为___________,Cu2O与Cu2S比较,熔点较高的是___________,原因为______________________。
(2)SO2与SO3的键角相比,键角更小的是___________。某种硫的氧化物冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构片段如图1所示。此固态物质中S原子的杂化轨道类型是___________;该物质的化学式为___________。
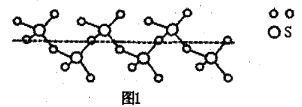
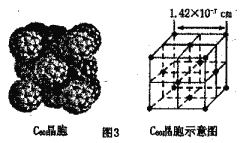
(3)离子化合物CaC2的晶体结构如图2所示。写出该物质的电子式___________。从钙离子看该晶体属于___________堆积,一个晶胞含有的π键平均有___________个。

(4)根据图3可知,与每个C60分子距离最近且相等的C60分子有___________个,其距离为___________cm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,容积均恒为2L的甲、乙、丙3个密闭容器中发生反应:
2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表:
2SO3(g) △H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表:
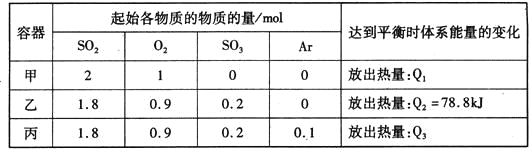
下列叙述正确的是
A. Q1>Q3>Q2=78.8kJ
B. 三个容器中反应的平衡常数均为K=2
C. 甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50%
D. 若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)=![]() mol/(L·min)
mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是硫的重要化合物,在生产、生活中有广泛应用,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如图所示:
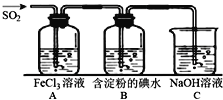
(1)写出由铜和浓硫酸制取SO2的化学方程式_____________________。
(2)装置A中的现象是__________。若要从A中的FeCl3溶液中提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在过滤操作中有用到的玻璃仪器有_______(填编号)。
A酒精灯 B烧瓶 C漏斗 D烧杯 E玻璃棒 F坩埚
(3)根据以上现象,该小组同学认为SO2与FeCl3发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式___________________;
②请设计实验方案检验有Fe2+生成__________________________;
(4)B中蓝色溶液褪色,表明I-的还原性比SO2__________(填“强”或“弱”)。
(5)若C中所得溶液只有一种溶质且pH>7,则溶液中各离子浓度大小顺序为_________。
(6)工业上通过煅烧黄铁矿产生SO2来进一步得到硫酸,已知煅烧1g FeS2产生7.1kJ热量,写出煅烧FeS2的热化学反应方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式书写正确的是( )
A.苯酚钠溶液中通入少量二氧化碳:2![]() + CO2 + H2O
+ CO2 + H2O ![]() 2
2![]() + Na2CO3
+ Na2CO3
B.乙酸乙酯的制备:CH3COOH + CH3CH218OH![]() CH3COOCH2CH3 + H218O
CH3COOCH2CH3 + H218O
C.用铁作电极电解饱和氯化钠溶液:2NaCl + 2H2O![]() 2NaOH + H2↑+ Cl2↑
2NaOH + H2↑+ Cl2↑
D.1-丙醇与钠反应:2CH3CH2CH2OH + 2Na → 2CH3CH2CH2ONa + H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是( )

A.①用pH试纸测某溶液的酸碱性
B.实验室用图②所示装置若先出现白色沉淀后又变黑,则能比较Ksp(AgCl)﹥Ksp(Ag2S)
C.实验室用图③所示装置证明酸性:H2SO4>H2CO3>H2SiO3
D.图④可由AlCl3饱和溶液制备AlCl3晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.二溴乙烷和水、溴苯和水、硝基苯和水三对物质都能用分液漏斗进行分离
B.苯与甲烷都不能使酸性高锰酸钾褪色,而甲苯能使酸性高锰酸钾褪色,则苯环使得甲基活化
C.甲苯与足量![]() 加成的产物的一氯代物有5种同分异构体
加成的产物的一氯代物有5种同分异构体
D.在溴乙烷中加入适量的氢氧化钠溶液,加热一段时间,再滴入几滴硝酸银溶液,会有沉淀析出,则溴乙烷在碱性条件下能水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )

A.滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键
B.该分子中的所有碳原子可能共平面
C.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
D.1 mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为3mol、7 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述不正确的是
A.若甲苯苯环上的一个氢原子被一个含3个碳原子的烷基取代,所得产物有6种
B.(CH3)2CHCl在浓硫酸作用下发生消去反应只得到一种烯烃
C.含有5个碳原子的饱和链烃,其一氯取代物共有8种
D.与![]() 互为同分异构体的芳香族化合物有6种
互为同分异构体的芳香族化合物有6种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com