
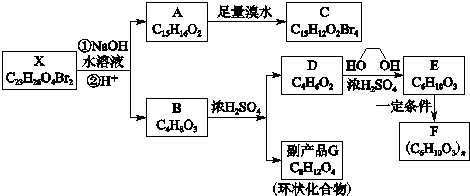
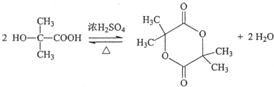
 .写出E→F反应的化学方程式
.写出E→F反应的化学方程式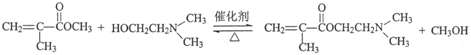 .
.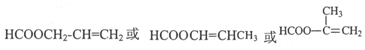 .
.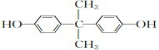 .
. 分析 利用A能与FeCl3溶液发生显色反应可知A中含有酚羟基,再结合其他信息和A→C转化条件和A、C分子式可知A中含有两个苯环,故A结构简式为: ,C为
,C为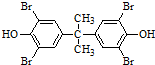 ;由此推出B中必含羧基,X为酚酯.再利用B→D与B→G反应可知B中还含有羟基,其中B→D发生的是消去反应、B→G发生的是酯化反应(生成环酯),结合题干中G的信息,可知B的结构简式为:
;由此推出B中必含羧基,X为酚酯.再利用B→D与B→G反应可知B中还含有羟基,其中B→D发生的是消去反应、B→G发生的是酯化反应(生成环酯),结合题干中G的信息,可知B的结构简式为: ,再利用反应①(酯的水解反应)和X的分子式,可推出X的结构简式为
,再利用反应①(酯的水解反应)和X的分子式,可推出X的结构简式为 ,进而可利用框图转化,结合有机物的性质可知D为CH2=C(CH3)COOH,E为CH2=C(CH3)COOCH2CH2OH,F为
,进而可利用框图转化,结合有机物的性质可知D为CH2=C(CH3)COOH,E为CH2=C(CH3)COOCH2CH2OH,F为 ,G为
,G为 ,结合有机物的结构和性质以及题目要求可解答该题.
,结合有机物的结构和性质以及题目要求可解答该题.
解答 解:利用A能与FeCl3溶液发生显色反应可知A中含有酚羟基,再结合其他信息和A→C转化条件和A、C分子式可知A中含有两个苯环,故A结构简式为: ,C为
,C为 ;由此推出B中必含羧基,X为酚酯.再利用B→D与B→G反应可知B中还含有羟基,其中B→D发生的是消去反应、B→G发生的是酯化反应(生成环酯),结合题干中G的信息,可知B的结构简式为:
;由此推出B中必含羧基,X为酚酯.再利用B→D与B→G反应可知B中还含有羟基,其中B→D发生的是消去反应、B→G发生的是酯化反应(生成环酯),结合题干中G的信息,可知B的结构简式为: ,再利用反应①(酯的水解反应)和X的分子式,可推出X的结构简式为
,再利用反应①(酯的水解反应)和X的分子式,可推出X的结构简式为 ,进而可利用框图转化,结合有机物的性质可知D为CH2=C(CH3)COOH,E为CH2=C(CH3)COOCH2CH2OH,F为
,进而可利用框图转化,结合有机物的性质可知D为CH2=C(CH3)COOH,E为CH2=C(CH3)COOCH2CH2OH,F为 ,G为
,G为 ,
,
(1)B的结构简式为 ,所以B的官能团名称是羟基和羧基,故答案为:羟基和羧基;
,所以B的官能团名称是羟基和羧基,故答案为:羟基和羧基;
(2)A→C的反应类型是取代反应,B发生消去反应生成D,故答案为:取代反应;消去反应;
(3)B→G反应的化学方程式为  ,E→F反应的化学方程式为
,E→F反应的化学方程式为  ,
,
故答案为: ;
; ;
;
(4)同时满足下列条件a.属于酯类,b.能发生银镜反应,即有醛基,c.链状化合物,符合这些条件的D的同分异构体有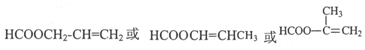 ,
,
故答案为: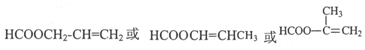 ;
;
(5)根据上面的分析可知,A结构简式为 ,故答案为:
,故答案为: .
.
点评 本题通过有机框图转化考查有机化学知识,意在考查考生对知识的应用和综合思维能力,题目难度中等,解答本题的关键是利用题中信息和有机物间转化关系图确定出各物质的结构简式,然后再回答有关问题.


科目:高中化学 来源: 题型:选择题
| A. | 元素的性质随着相对原子质量的递增而呈周期性变化 | |
| B. | 两个原子如果核外电子排布相同,一定是同一种元素 | |
| C. | 原子的次外层电子数不一定是8个 | |
| D. | 一切原子的原子核都是由质子和中子构成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方案 | 实验现象 |
| ①镁条除去氧化膜后,放入试管中,加入少量水,加热至沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变红色 |
| ②向新制得的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将除去氧化膜的镁条投入稀盐酸中 | D.反应不十分剧烈,产生无色气体 |
| ⑤将除去氧化膜的铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 |
| 实验方案 | ② | ④ | ⑥ |
| 实验现象(填A~F) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 铜、碳、氮、硫、氯等是组成物质的重要元素.
铜、碳、氮、硫、氯等是组成物质的重要元素.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 加入的试剂 | H2的体积(相同条件下) | 反应时间 | 反应速率 |
| 1mol/L硫酸溶液 | 10mL | t1 | v1 |
| 4mol/L硫酸溶液 | 10mL | t2 | v2 |
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 硫酸浓度(mol/L) | 4.0 | 3.8 | 3.5 | 3.1 | 2.6 | 2.2 | 1.9 | 1.8 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 编号 | 实验操作 | 实验现象 | 结论及解释 |
1 | 分别取4中溶液,滴加紫色石蕊溶液 | 溶液变红的是① ④溶液 | 略 |
2 | 向含酚酞的NaOH溶液中,各滴加等量②③两 | ②中无明显现象 ③中红色明显变浅 | 滴加③时反应的化学的化学方程式: |
| 3 | 测定CH3COOH溶液 与H2CO3溶液的溶液的酸性 | 略 | CH3COOH溶液的酸性远大于H2CO3溶液 |
| 4 | 将CO2通入C6H5ONa溶液中 | 反应的化学方程式: | |
| 结论:由强到弱顺序(填序号) | |||

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种金属产生氢气的量相同 | |
| B. | 钠反应生成的氢气的量最多 | |
| C. | 铝反应产生的氢气的量最多 | |
| D. | 钠、镁与酸反应生成的氢气的量相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com