
【题目】下列根据反应原理设计的应用,不正确的是( )
A.![]() +H2O
+H2O![]()
![]() +OH- 用热的纯碱溶液清洗油污
+OH- 用热的纯碱溶液清洗油污
B.Al3++3H2O![]() Al(OH)3(胶体)+3H+ 明矾净水
Al(OH)3(胶体)+3H+ 明矾净水
C.TiCl4+(x+2)H2O(过量)![]() TiO2·xH2O↓+4HCl制备TiO2纳米粉
TiO2·xH2O↓+4HCl制备TiO2纳米粉
D.SnCl2+H2O![]() Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
【答案】D
【解析】
A. CO32+H2OHCO3+OH-,纯碱是碳酸钠,溶于水后碳酸根离子存在水解平衡,水解是吸热的,热的纯碱可以促进水解,油脂在碱性溶液中发生水解生成高级脂肪酸钠和甘油,故A正确;
B. 明矾溶于水电离产生的Al3+水解生成Al(OH)3胶体,Al(OH)3胶体能吸附水中悬浮的杂质,从而起到净水作用,故B正确;
C. TiCl4+(x+2)H2O(过量)TiO2·xH2O↓+4HCl,TiCl4易水解生成二氧化钛晶体,失水后可制取TiO2纳米粉,故C正确;
D. 配制SnCl2溶液时应加入稀盐酸抑制SnCl2水解,加入NaOH会促进SnCl2的水解,而发生变质,故D错误;
答案选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)N、P、As的第一电离能由大到小的顺序为___;基态As原子的核外电子排布式为___。
(2)NH3的沸点比PH3的___(填“高”或低”),原因是___。
(3)Na3AsO4中含有的化学键类型包括___,AsO43-的空间构型为___。
(4)白磷(P4)晶体属于分子晶体,其晶胞结构如图所示(小圆圈表示白磷分子)。已知晶胞的边长为acm,阿伏加德罗常数为NAmol-1,则该晶胞中含有的P原子的个数为___,该晶胞的密度为___g·cm-3(用含NA、a的式子表示)。
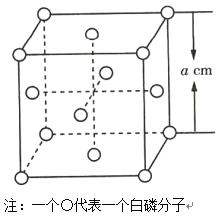
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用 NH4Cl、盐酸、NaClO2 为原料制备 ClO2 的过程如下图所示,下列说法不正确的是
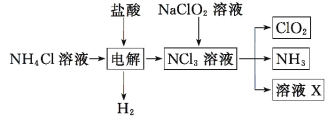
A.X 中大量存在的阴离子有 Cl-和 OH-B.NCl3 的键角比 CH4 的键角大
C.NaClO2 变成 ClO2 发生了氧化反应D.制取 3 mol ClO2 至少需要 0.5mol NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,将20mL3xmol·L-1Na3AsO3、20mL3xmol·L-1I2和20mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq)![]() AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43- 与反应时间(t)的关系如图所示。下列不能判断反应达到平衡的是
AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43- 与反应时间(t)的关系如图所示。下列不能判断反应达到平衡的是
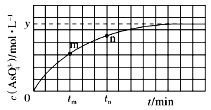
A. 溶液的pH不再变化
B. 2v正(I-)=v逆(AsO33-)
C. c(AsO43-)/c(AsO33-)不再变化
D. c(I-)=2ymol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G都是有机化合物,它们的转化关系如下:
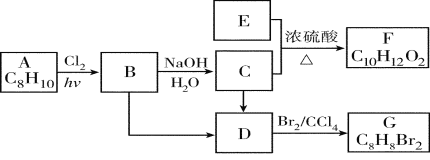
请回答下列问题:
(1)已知:6.0 g化合物E完全燃烧生成8.8 g CO2和3.6 g H2O;E的蒸气与氢气的相对密度为30,则E的分子式为________;
(2)A为一取代芳烃,B中含有一个甲基。由B生成C的化学方程式为:________________;
(3)由B生成D的反应条件是________________;
(4)在G的同分异构体中,苯环上一硝化的产物只有一种的共有________个,其中核磁共振氢谱有两组峰,且峰面积比为1∶1的是_________(填结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10。现向1 L 0.2 mol·L-1 HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中正确的是
A.25 ℃时,0.1 mol·L-1 HF溶液中pH=1B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中有CaF2沉淀产生D.该体系中,Ksp(CaF2)=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为相互串联的甲、乙两电解池,其中甲池为电解精炼铜的装置。
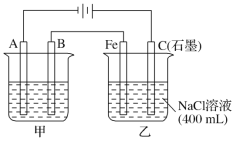
试回答下列问题:
(1)A是________极,材料是________,电极反应为_____________,B是________极,材料是________,主要电极反应为_________________,电解质溶液为________。
(2)乙池中若滴入少量酚酞溶液,电解一段时间后Fe极附近溶液呈________色。
(3)常温下,若甲池中阴极增重12.8 g,则乙池中阳极放出的气体在标准状况下的体积为________。若此时乙池剩余液体为400 mL,则电解后得到碱液的物质的量浓度为________,pH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1887年,英国人赫勒森发明了最早的干电池,如今干电池已经发展成为一个庞大的家族,种类达100多种。应用广泛的是Zn—MnO2干电池,其电解质溶液是ZnCl2—NH4Cl混合溶液。电池工作一段时间后,电池内存在7种物质:NH3、Mn2O3、ZnCl2、MnO2、NH4Cl、Zn和H2O。请回答下列问题
(1)该电池的负极材料是__;电池工作时,电子流向__(填“正极”或“负极”,下同);放电时NH4+向___移动。
(2)该氧化还原反应的化学方程式为__,发生还原反应的物质是__,被氧化的元素是__。若有17.4g氧化剂参与反应,则电子转移数目为__NA(NA表示阿伏加德罗常数的值)。
(3)普通锌锰电池的缺点是电量小、放电电流弱。为增大放电电流,可把负极锌片改为锌粉,其理由是___。
(4)若ZnCl2—NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是__。欲除去Cu2+,最好选用下列试剂中的__(填序号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】薄荷油中含有少量a—非兰烃,其相对分子质量为 136。根据如下转化,回答相关问题。
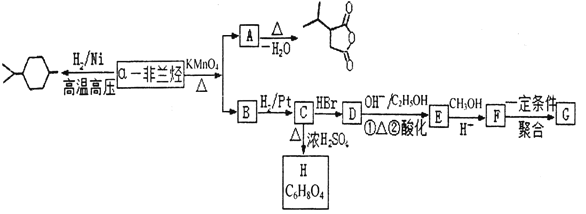
已知:Ⅰ. ![]()
![]()
![]() +RCOOH
+RCOOH
Ⅱ. ![]()
![]()
![]() +CO2
+CO2
Ⅲ.2CH3COOH![]()
![]()
(1)a—非兰烃的结构简式为______。
(2)B 中含有的官能团名称为______,C→D 的反应类型为______。
(3)C→H 的反应方程式为______。
(4)写出符合下列条件 A 的同分异构体______(写三种即可)。
①含有 4 个—CH3②1mol 此同分异构体在碱性条件下水解需 2mol NaOH。
(5)以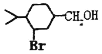 为原料合成
为原料合成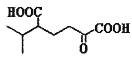 ______。(用流程图表示,其他无机试剂任选)
______。(用流程图表示,其他无机试剂任选)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com