
| ||
| ||


科目:高中化学 来源: 题型:
| 离子半径 | 酸性 | 还原性 | 得电子能力 |
| N3- | H2SO4 | O2- | 35Cl |
查看答案和解析>>
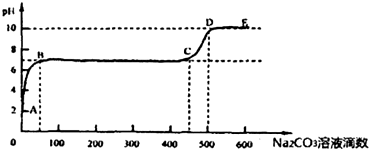
科目:高中化学 来源: 题型:
| A、该溶液中C(H+)≠C(OH-) |
| B、100℃时,Na2CO3溶液中KW=1×10-14 |
| C、100℃时,0.1 mol?L-1NaOH溶液pH=11 |
| D、100℃时,0.1 mol?L-1H2SO4溶液中,水电离产生C(H+)=1.0×10-11mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、OH-Ba2+NO3-K+ |
| B、Na+ SO42- Cu2+ Cl- |
| C、HCO3- Cl- Na+ Ba2+ |
| D、Fe3+ Al3+ I- NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中c(H+)=c(Cl-) |
| B、与等体积pH=12的氨水混合后所得溶液显酸性 |
| C、由HCl电离出的H+约为由H2O电离出H+浓度的1010倍 |
| D、与等体积O.01 mol?L-1碳酸钠溶液混合后所得溶液中:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、被氧化 |
| B、被还原 |
| C、既被氧化又被还原 |
| D、既未被氧化又未被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHS溶液的水解方程式:HS-+H2O?H3O++S2- |
| B、足量的硫酸铝溶液与纯碱溶液反应:2A13++3CO32-+3H2O=2A1(OH)3↓+3CO2↑ |
| C、Fe(OH)3与足量的HI溶液反应:Fe(OH)3+3H+=Fe3++3H2O |
| D、向亚硫酸氢铵溶液中加入足量的NaOH溶液:NH4++OH-=NH3?H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com