
查处酒后驾驶采用的“便携式乙醇测量仪”
以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其
中一个电极的反应式为:CH3CH2OH—2e—→X+ 2H+.下列说法中正确的是( )
2H+.下列说法中正确的是( )
A.电池内部H+由正极向负极移动
B.另一极的电极反应式为:O2+4e—+2H2O=4OH—
C.乙醇在正极发生反应,电子经过外电路流向负极
D.电池总反应为:2CH3CH2OH + O2→2CH3CHO + 2H2O
科目:高中化学 来源: 题型:
A、B、C、D、E五种物质都含有同一元素,它们按下图所示关系相互转化,已知A为单质。
(1)写出A~E的化学式
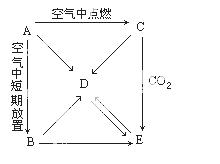
(2)分别写出有关反应的化学方程式,其中属于氧化还原反应的, 请标出电子转移的方向和数目
①A→B:________ ②A→C:________
③A→D:________ ④C→D:________
⑤C→E:________ ⑥D→E:________
查看答案和解析>>
科目:高中化学 来源: 题型:
用含少量镁粉的铝粉制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是
( )
①加盐酸溶解 ②加烧碱溶液溶解 ③过滤 ④通入过量CO2生成Al(OH)3沉淀 ⑤加入盐酸生成Al(OH)3沉淀 ⑥加入过量烧碱溶液
A.①⑥⑤③ B.②③④③ C.②③⑤③ D.①③⑤③
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量。实验步骤如下:
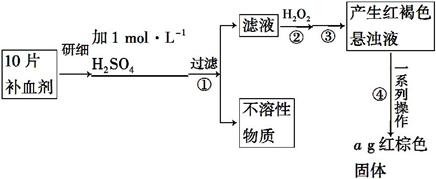
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是:取样,先滴加KSCN溶液,再滴加 ,该过程的现象为__________________________________________。
(2)步骤②加入过量H2O2的目的是 _____________________________________。
(3)步骤③中反应的离子方程式是 _____________________________________。
(4)步骤④中一系列处理的操作步骤:过滤、________ 、灼烧、 、称量。
(5)若实验中铁无损耗,则每片补血剂中含铁元素的质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
镁一过氧化氢燃料电池具有比能量高、安
全方便等优点,其总反应为Mg+H2O2+H2SO4 MgSO4+2H2O,结构示意图如图所示。下列关于该电池 的
的
叙述正确的是
A.电池内部可以使用MnO2作填料
B.电池工作时,H+向Mg电极移动
C.电池工作时,正极的电板反应式为Mg—2e— Mg2+
D.电池工作时,电解质溶液的pH将不断变大
查看答案和解析>>
科目:高中化学 来源: 题型:
铁棒和石墨棒用导线连接后,浸入0. 01mol/L 的氯化钠溶液中,下列说法正确的是
A.铁棒附近产生OH— B.铁棒质量减少
C.石墨棒上放出氢气 D.石墨棒上放出氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
上海世博会期间,在德国馆的汉堡之家展馆人们看到一个1∶20飞机燃料电池的模型。燃料电池是一
种通过氢氧结合来发电的电化学装置。某氢氧燃料电池的电池反应为2H2+O2===2H2O,电解液为KOH溶
液。氢氧燃料电池的突出优点是把________能直接转化为________能,而不用经过________能这一中间形
式。
 (1)有关氢氧燃料电池的下列叙述中,正确的是 ( )
(1)有关氢氧燃料电池的下列叙述中,正确的是 ( )
A.此电池能发出蓝色火焰
B.氢气为正极,氧气为负极
C.因为生成水,所以工作时溶液的碱性越来越强
D.负极上氢气失电子,发生氧化反应;正极上氧气得电子,发生还原反应
(2)该电池所产生的水可以作为饮用水,今欲制得 常温下1 L水,则电池内转移电子的物质的量为________。
常温下1 L水,则电池内转移电子的物质的量为________。
A.8.9×10-3 mol B.4.5×10-2 mol
C.1.1×102 mol D.5.6×103 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl -KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca = CaCl
-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca = CaCl 2+Li2SO4+Pb。
2+Li2SO4+Pb。
下列有关说法正确的是
A.正极反应式:Ca +  2Cl--2e- = CaCl2
2Cl--2e- = CaCl2
B.放电过程中,Li+向负极移动
C.没转移0.1mol电子,理论上生成20.7 g Pb
D.常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学物质在实际生产生活和科技等方面的应用不正确的是( )
A.测定NaOH熔点时,可以将NaOH放入石英坩埚中高温加热
B.石英砂可以用于制取高纯度的硅,硅是将太阳能转化为电能的常用材料
C.因为氨易液化,液氨在气化时会吸收大量的热量,所以液氨可作制冷剂
D.硫酸和硝酸都是重要的工业原料,工业上可用于制化肥、农药和炸药
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com