
【题目】侯氏制碱法原理:NaCl+H2O+CO2+NH3=NaHCO3↓+NH4Cl,下列相关化学用语正确的是
A.中子数为8的氮原子:![]()
B.氧原子的结构示意图:
C.NaHCO3的电离方程式:NaHCO3=Na++H++![]()
D.CO2的球棍模型:![]()
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】已知某可逆反应mA(g)+nB(g)pC(g)在密闭容器中进行,如图表示反应时间 t时、温度 T 和压强P 与反应混合气体中 C 的体积分数(C%)的关系曲线,由曲线分析,下列判断正确的是
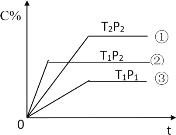
A.T1<T2 P1>P2 m+n<p ΔH>0
B.T1>T2 P1<P2 m+n>p ΔH<0
C.T1<T2 P1>P2 m+n<p ΔH<0
D.T1>T2 P1<P2 m+n>p ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量A、B混合气体发生反应:aA(g)+bB(g)![]() cC(g)。平衡时测得A的浓度为0.5mol/L;保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度为0.28mol/L。下列有关判断正确的是
cC(g)。平衡时测得A的浓度为0.5mol/L;保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度为0.28mol/L。下列有关判断正确的是
A. a+b=cB. 该变化使平衡正向移动
C. B的转化率降低D. C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验现象和解释或结论都正确的是()
选项 | 实验操作 | 现象 | 解释或结论 |
A | 把SO2通入紫色石蕊试液中 | 紫色先变红后褪色 | SO2具有漂白性 |
B | 向AgCl沉淀中清加KI溶液 | 白色沉淀变为黄色 | 溶度积:AgI比AgCl更小 |
C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变浅 | 反应2NO2 |
D | 把浓硫酸滴到pH试纸上 | 试纸变红 | 浓硫酸具有酸性 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据如图中氮元素及其化合物的转化关系,回答问题:
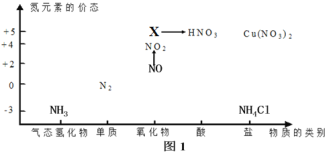
(1)图1中,X的化学式为________________;
(2)回答下列关于NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为:________________;
②下列试剂不能用于干燥NH3的是________________(填字母)。
A.浓硫酸B.碱石灰C.NaOH固体
③氨气是重要的化工原料,可以合成多种物质,写出催化氧化的化学方程式:________________;
(3)回答下列关于NO、NO2的问题:
①汽车排气管上装有催化转化器可减少尾气对环境的污染,发生的反应为:2NO+2CO![]() N2+2CO2该反应中,被氧化的物质是________________(填化学式),若反应中生成1molN2,则转移电子________________mol;
N2+2CO2该反应中,被氧化的物质是________________(填化学式),若反应中生成1molN2,则转移电子________________mol;
②NO→NO2的颜色变化是________________;
(4)工业生产中利用氨水吸收SO2和NO2,原理如图所示:
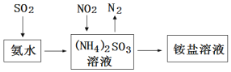
NO2被吸收过程的离子方程式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述不正确的是
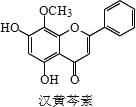
A.汉黄芩素的分子式为 C16H12O5
B.该物质遇 FeCl3 溶液显色
C.1 mol 该物质与溴水反应,最多消耗 2mol Br2
D.与足量 H2 发生加成反应后,该分子中官能团的种类减少 3 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)是工业生产硫酸的重要步骤,T℃时该反应过程中的能量变化如图所示:
2SO3(g)是工业生产硫酸的重要步骤,T℃时该反应过程中的能量变化如图所示:
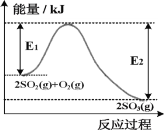
(1)2SO2(g)+O2(g)![]() 2SO3(g)ΔH=___________kJ·mol-1(
2SO3(g)ΔH=___________kJ·mol-1(![]() 含E1、E2的计算式表示)
含E1、E2的计算式表示)
(2)①下列措施不能使该反应速率加快的是___________。
A.升高温度 B.降低压强 C.使用催化剂
②若上述反应在恒容的密闭容器中进行,下列叙述中能说明该反应已达平衡状态的是___________。
A.SO3的浓度不再变化
B.SO2与SO3的物质的量相等
C.容器内气体的压强不再变化
D.单位时间内消耗1molO2,同时消耗2molSO2
(3)运用电化学原理可生产硫酸,总反应为2SO2+O2+2H2O=2H2SO4,装置如图所示。其中质子交换膜将该原电池分隔成氧化反应室和还原反应室,能阻止气体通过而允许H+通过。
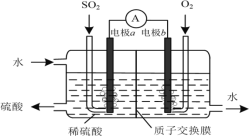
①该电池的负极是___________。(填“电极a”或“电极b”)
②H+通过质子交换膜时的移动方向是___________。
A.从左向右 B.从右向左
③通入O2的电极反应式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,则下列说法中,正确的是( )
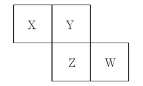
A.原子半径:W>Z>Y>X
B.形成氢化物的稳定性:Z>W
C.常温下:X、Y、Z、W形成的常见单质均为气态
D.W的单质能与水反应,生成一种具有漂白性的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积不变的密闭容器中发生反应N2(g)+3H2(g)![]() 2NH3(g),下列叙述表示该反应处于化学平衡状态的是( )
2NH3(g),下列叙述表示该反应处于化学平衡状态的是( )
A.N2、H2、NH3的浓度之比为1∶3∶2
B.混合气体的密度不随时间变化
C.当有1molN≡N键断裂时,有6molN—H键断裂
D.单位时间内生成2amolNH3,同时消耗amolN2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com