
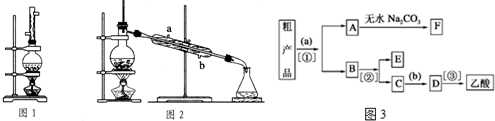
 肼是重要的化工原料,某探究小组利用下列反应制取水合肼(N2H4•H2O):
肼是重要的化工原料,某探究小组利用下列反应制取水合肼(N2H4•H2O):分析 (1)氯气通入到盛有NaOH的锥形瓶中发生反应生成氯化钠、次氯酸钠和水;
(2)依据制取水合肼(N2H4•H2O)的反应原理为:CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl,结合反应产物和反应物分析判断;水合肼(N2H4•H2O)具有还原性,易被次氯酸钠氧化;
(3)水合肼与碘溶液反应发生氧化还原反应,生成氮气、碘化氢和水;NaHCO3能控制溶液的pH在6.5左右,是因为碳酸氢钠和碘化氢反应;
(4)碘单质具有氧化性,选择酸式滴定管盛装进行实验;结合反应定量关系计算得到馏分中水合肼(N2H4•H2O)的质量分数;
(5)为获得更可靠的滴定结果,步骤d中进一步操作是重复bc几次,结合测定结果计算体积的平均值,得到结果更准确.
解答 解:(1)氯气通入到盛有NaOH的锥形瓶中发生反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O;
故答案为:Cl2+2OH-=ClO-+Cl-+H2O;
(2)依据制取水合肼(N2H4•H2O)的反应原理为:CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl,结合反应产物和反应物分析判断,分液漏斗中的溶液是NaOH和NaClO混合溶液;水合肼(N2H4•H2O)具有还原性,易被次氯酸钠氧化,如果次氯酸钠溶液装在烧瓶中,反应生成的水合肼会被次氯酸钠氧化;
故答案为:A;如果次氯酸钠溶液装在烧瓶中,反应生成的水合肼会被次氯酸钠氧化;
(3)水合肼与碘溶液反应发生氧化还原反应,生成氮气、碘化氢和水,反应的化学方程式为:N2H4•H2O+2I2=N2↑+4HI+H2O;NaHCO3能控制溶液的pH在6.5左右,是因为碳酸氢钠和碘化氢反应;
故答案为:N2H4•H2O+2I2=N2↑+4HI+H2O;生成的HI与NaHCO3 反应;
(4)碘单质具有氧化性,选择酸式滴定管盛装进行实验;结合反应定量关系计算得到馏分中水合肼(N2H4•H2O)的质量分数,
N2H4•H2O+2I2=N2↑+4HI+H2O;
1 2
n 0.2000mol/L×0.018L
n=0.0018mol
250ml溶液中含有的物质的量=0.0018mol×$\frac{250}{25}$=0.018mol
水合肼(N2H4•H2O)的质量分数=$\frac{0.018mol×50g/mol}{5.00g}$×100%=18.0%
故答案为:酸式;18.0%;
(5)为获得更可靠的滴定结果,步骤d中进一步操作是重复bc几次,结合测定结果计算体积的平均值,得到结果更准确;
故答案为:重复步骤b和c 2~3次,依据测得的结果,取平均值.
点评 本题考查了物质制备和性质的实验分析和验证方法应用,主要是过程分析判断,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在水中溶解性:Na2CO3>NaHCO3 | |
| B. | 热稳定性:Na2CO3<NaHCO3 | |
| C. | 与酸反应的速度:Na2CO3>NaHCO3 | |
| D. | Na2CO3不能转化成NaHCO3,而NaHCO3能转化为Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、K+、NO3-、Cl- | B. | Na+、K+、Cl-、OH- | ||
| C. | H+、Ba2+、CO32-、SO42- | D. | Na+、K+、OH-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1的NaCl溶液 | B. | 75 mL 2 mol•L-1NH4Cl溶液 | ||
| C. | 150 mL 2 mol•L-1的KCl溶液 | D. | 100 mL 1.5 mol•L-1FeCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中溶液变浑浊,可能有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有Ag+ | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润蓝色石蕊试纸变红,一定有NH4+ | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com