
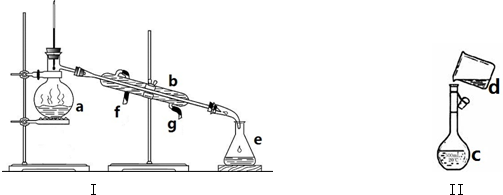
分析 (1)由图可知仪器的名称;
(2)具有塞子或活塞的仪器,使用前需要查漏;
(3)四氯化碳和酒精的混合物互溶,沸点不同,选蒸馏法分离,冷却水下进上出在冷凝管中停留时间长,效果好;
(4)转移液体需要引流.
解答 解:(1)由图可知仪器的名称a、b、c分别为蒸馏烧瓶、直形冷凝管、容量瓶,故答案为:蒸馏烧瓶;直形冷凝管;容量瓶;
(2)具有塞子或活塞的仪器,使用前需要查漏,则仪器a~e中,使用前必须检查是否漏水的有c,故答案为:c;
(3)四氯化碳和酒精的混合物互溶,沸点不同,选蒸馏法分离,冷却水下进上出在冷凝管中停留时间长,效果好,则图中还缺少的仪器是酒精灯,将仪器补充完整后进行实验,冷凝水由g口通入f口流出,
故答案为:酒精灯;g;f;
(4)转移液体需要引流,则图中的错误是未用玻璃棒引流,
故答案为:未用玻璃棒引流.
点评 本题考查混合物分离提纯,为高频考点,把握仪器的使用、实验装置的作用、混合物分离提纯、实验技能为解答的关键,侧重分析与实验能力的考查,注意需要查漏的仪器,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:选择题
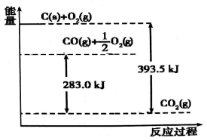
| A. | 1mol C完全燃烧生成CO2时放出的热量为393.5 kJ/mol | |
| B. | 2C(s)+O2(g)═2CO(g)△H=-221.0 kJ/mol | |
| C. | 2CO2 (g)═2CO(g)+O2(g)△H=+283.0 kJ/mol | |
| D. | C(s)+O2(g)═CO2 (g)△H=+393.5 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 糖类 | 油脂 | 蛋白质 | 其他 | |
| 花生米 | 24% | 39% | 26% | 11% |
| 小麦 | 76% | 2% | 11% | 11% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com