
 组成蛋白质的元素主要有C、H、O、N及S、P和少量的Zn、Cu等.
组成蛋白质的元素主要有C、H、O、N及S、P和少量的Zn、Cu等.| 共价键 | C-C | C-N | C-S |
| 键能/(kJ?mol-1) | 347 | 305 | 259 |


科目:高中化学 来源: 题型:
| A、含氧原子个数比为2:3 |
| B、含硫元素质量比为5:4 |
| C、含氧元素质量比为5:6 |
| D、含硫原子个数比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(B) |
| c(C) |
查看答案和解析>>
科目:高中化学 来源: 题型:
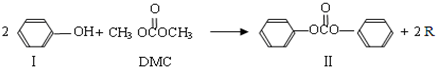
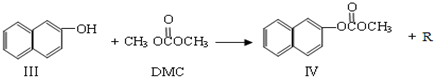
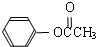 )在催化剂作用下也能生成化合物Ⅱ,同时得到一种副产品G,下列有关G的说法正确的是
)在催化剂作用下也能生成化合物Ⅱ,同时得到一种副产品G,下列有关G的说法正确的是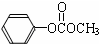 ),H的同分异构体有多种,请写出符合下列条件的H的一种同分异构体
),H的同分异构体有多种,请写出符合下列条件的H的一种同分异构体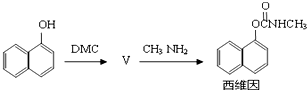
查看答案和解析>>
科目:高中化学 来源: 题型:
| Cu2O/ZnO |
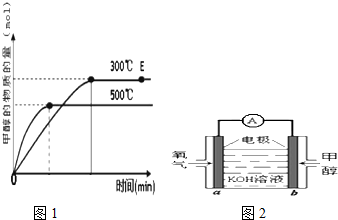
| 1 |
| 2 |
| c(CH3OH) |
| c(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)/mol.L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| C(CO)/mol.L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稳定性:PH3>H2S>HCl |
| B、碱性:NaOH>Mg(OH)2>Al(OH)3 |
| C、酸性:HClO4>HBrO4>HIO4 |
| D、非金属性:F>O>S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com