
【题目】能源危机是当前全球问题,开源节流是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是________(填序号)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源、减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们燃烧氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示。

在通常状况下,金刚石和石墨中________(填“金刚石”或“石墨”)更稳定.
(3)二甲醚又称甲醚,简称DME,熔点为-141.5℃,沸点为-24.9℃。二甲醚与液化石油气(LPG)相似,被誉为“21世纪的清洁燃料”。由合成气(CO、H2)制备二甲醚的反应原理如下:
a.CO(g)+2H2(g)![]() CH3OH(g) △H1= -90.0 kJ·mol-1
CH3OH(g) △H1= -90.0 kJ·mol-1
b.2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mol-l
CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mol-l
回答下列问题:
①反应a在__________ (填“低温”或“高温”)下易自发进行。
②写出由合成气(CO、H2) 直接制备二甲醚的热化学方程式:__________________________________。
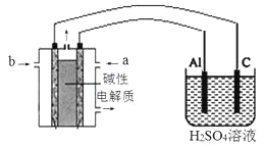
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池。以此电池作电源,在实验室中模拟铝制品表面“钝化”处理过程(装置如图所示)。其中物质b是__________, 阳极电极反应为__________________________________________________。
【答案】 acd 石墨 低温 2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) △H= -200 kJ·mol-l 甲醇(或CH3OH) 2Al+3H2O-6e- =Al2O3 +6H+
CH3OCH3(g)+H2O(g) △H= -200 kJ·mol-l 甲醇(或CH3OH) 2Al+3H2O-6e- =Al2O3 +6H+
【解析】(1)只要能减少化石燃料等资源的运用都属于“开源节流”;(2)依据物质能量越高,物质越不稳定;(3)依据△G=△H-T△S判断反应的自发性,结合热化学方程式和盖斯定律计算得到;(4)根据电解池确定阴阳极,然后确定燃料电池的正负极,写出电极反应式。
(1)大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源,有助于能源“开源节流”,a选项符合要求;煤、石油、天然气都是化石燃料,是不可再生的,所以大力开采煤、石油和天然气以满足人们日益增长的能源需求是错误的,不可取的,b选项不符合要求;开发新能源、减少使用煤、石油等化石燃料,c选项符合要求;减少资源消耗,增加资源的重复使用、循环再生,d选项符合要求,正确选项acd;
(2)根据图像可知,金刚石的总能量大于石墨的,所以石墨比金刚石稳定,正确答案:石墨;
(3)①CO(g)+2H2(g)![]() CH3OH(g); △H1= -90.0 kJ·mol-1,△S<0,△H<0,反应能够自发进行,说明在△G=△H-T△S中△G<0,所以T的值要小,即低温下自发进行,正确答案:低温;
CH3OH(g); △H1= -90.0 kJ·mol-1,△S<0,△H<0,反应能够自发进行,说明在△G=△H-T△S中△G<0,所以T的值要小,即低温下自发进行,正确答案:低温;
②根据盖斯定律,将①×2+②得:2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) △H= -200 kJ·mol-l,正确答案:2CO(g)+4H2(g)
CH3OCH3(g)+H2O(g) △H= -200 kJ·mol-l,正确答案:2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) △H= -200 kJ·mol-l;
CH3OCH3(g)+H2O(g) △H= -200 kJ·mol-l;
(4)铝制品表面 “钝化”处理过程是铝失去电子生成Al2O3的过程,所以铝是阳极,对应的燃料电池是正极,所以a通入的是氧气,b极是甲醇,铝电极发生反应的电极方程式:2Al-6e-+3H2O=Al2O3+6H+,正确答案:甲醇;2Al-6e-+3H2O=Al2O3+6H+。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 相同温度时,气体分子间的距离一定相等
B. 2gH2和2gO2能恰好反应生成4gH2O
C. 3.2gO3中含有的氧原子数为1.204×1023个
D. 1 mol·L-1 MgCl2溶液中含Cl-数为1.204×1024个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锅炉水垢既会降低燃料的利用率、影响锅炉的使用寿命,还可能造成安全隐患。某锅炉水垢的主要成分有CaCO3、CaSO4、Mg(OH)2、Fe2O3,用酸洗法可除去该水垢,其基本原理如下图所示。
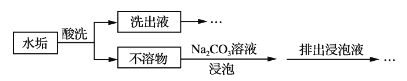
(1)“酸洗”时,一般不选用稀硫酸的原因是_______________________________。
(2)“不溶物”用碳酸钠溶液浸泡的目的是________________________________(用离子方程式表示)。
(3)为防止洗出液中的Fe3+腐蚀铁质管道,常在洗出液中加入SnCl2溶液,反应中Sn2+转化为Sn4+,则Sn2+与Fe3+反应的物质的量之比为________。
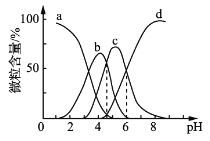
(4)柠檬酸(用H3R表示)可用作酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图所示。图中a曲线所代表的微粒的百分含量随溶液pH的改变而变化的原因是_____________________(用平衡移动原理解释)。HR2-电离常数为Ka3,请根据图示信息计算出pKa3=________(pKa3=-lgKa3)。
(5)利用如图2所示装置对锅炉水(含Ca2+、Mg2+、HCO3—)进行预处理,可有效防止锅炉水垢的形成。写出电解过程中,Ca2+形成沉淀的电极反应方程式:______________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+,Mg2+,SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序:①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液
A.②⑤④①③B.④①②⑤③
C.④②⑤①③D.①④②⑤③
查看答案和解析>>
科目:高中化学 来源: 题型:
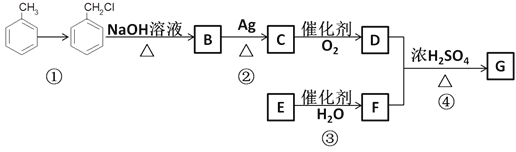
【题目】某有机物的合成路线如下,完成下列内容
已知:①R—Cl![]() R—OH;②RCHO
R—OH;②RCHO![]() RCOOH;
RCOOH;
③E的产量可衡量一个国家石油化工的发展水平
(1)反应①反应条件为____________。
(2)B中所含官能团名称为___________。
(3)反应②的化学方程式为________________________________________________________。
简述验证是有C生成的操作及现象___________________________。
(4)反应③的反应类型为__________。
(5)反应④的化学方程式为___________________________________________________。
(6)G有很多同分异构体,则满足下列条件的同分异构体有________种。
①含有一个羧基 ②含有一个苯环 ③苯环上有三个取代基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为 ,分析其结构,并回答下列问题:
,分析其结构,并回答下列问题:
(1)写出其分子式:____________________________________________。
(2)其中含有____个不饱和碳原子,分子中有____个双键。
(3)分子中的极性键有__________(写出2种即可)。
(4)分子中的饱和碳原子有______个,一定与苯环处于同一平面的碳原子有______个。
(5)分子中C—C===O键角约为__________,H—C≡C键角约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:2X(g)+Y(g)2Z(g)在不同温度和压强下的产物Z的物质的量和反应时间t的关系如下图所示:下列判断正确的是( )
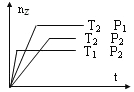
A. P1>P2 T1>T2 ΔH<0B. P1>P2 T1<T2 ΔH<0
C. P1>P2 T1>T2 ΔH>0D. P1<P2 T1<T2 ΔH>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com