
| 滴定次数 | 待测溶液 体积/mL | 草酸溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.50 | 23.70 |
| 2 | 25.00 | 1.02 | 26.03 |
| 3 | 25.00 | 0.00 | 24.99 |
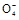 +2H2O+5SO2
+2H2O+5SO2 2Mn2++5S
2Mn2++5S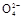 +4H+
+4H+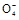 +6H++5H2C2O4
+6H++5H2C2O4 2Mn2++10CO2↑+8H2O
2Mn2++10CO2↑+8H2O| 编号 | 温度/℃ | 酸化的H2C2O4 溶液/mL | KMnO4 溶液/mL | 溶液褪 色时间/s |
| 1 | 25 | 5.0 | 2.0 | 40 |
| 2 | 25 | 5.0(另加少量可溶 于水的MnSO4粉末) | 2.0 | 4 |
| 3 | 60 | 5.0 | 2.0 | 25 |
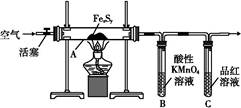
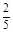 ×10="0.001" mol,与SO2反应的KMnO4的物质的量为:0.05 L×0.1 mol·L-1-0.001 mol="0.004" mol,n(SO2)="0.004" mol×2.5="0.01" mol,n(S)="0.01" mol×32 g·mol-1="0.32" g;0.6 g固体为Fe2O3,n(Fe)=
×10="0.001" mol,与SO2反应的KMnO4的物质的量为:0.05 L×0.1 mol·L-1-0.001 mol="0.004" mol,n(SO2)="0.004" mol×2.5="0.01" mol,n(S)="0.01" mol×32 g·mol-1="0.32" g;0.6 g固体为Fe2O3,n(Fe)=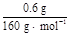 ×2 mol="0.007" 5 mol,m(Fe)="0.007" 5 mol×56 g·mol-1="0.42" g;
×2 mol="0.007" 5 mol,m(Fe)="0.007" 5 mol×56 g·mol-1="0.42" g;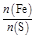 =
=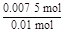 =
=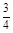 ,所以该铁硫簇结构的化学式为Fe3S4。(5)1、2对比,增加Mn2+,反应速率加快;1、3对比,温度升高,反应速率加快。
,所以该铁硫簇结构的化学式为Fe3S4。(5)1、2对比,增加Mn2+,反应速率加快;1、3对比,温度升高,反应速率加快。

科目:高中化学 来源:不详 题型:实验题
 NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0 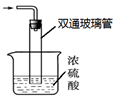

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

| 离子 | Al3+ | Fe3+ | Ni2+ |
| pH | 5.2 | 4.1 | 9.7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 实验操作 | 现象 | 解释或结论 |
| A | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X中一定含有SO42- |
| B | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | HA放出的氢气多且反应速率快 | HB酸性比HA强 |
| C | 在镁、铝为电极,氢氧化钠为电解质的原电池装置中 | 镁表面有气泡 | 金属活动性:Al>Mg |
| D | 向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后加入0.5 mL有机物Y加热 | 未出现砖红色沉淀 | Y中不含有醛基 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

 NH4NO2+NaCl
NH4NO2+NaCl NH3↑+HNO2
NH3↑+HNO2 N2O3↑+H2O
N2O3↑+H2O 2N2+3H2O
2N2+3H2O| N2和H2的体积比 | 5∶1 | 3∶1 | 1∶1 | 1∶3 | 1∶5 |
| 酚酞变红色所需时间/min | 8~9 | 7~8 | 6~7 | 3~4 | 9~10 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 序号 | 实验内容 | 实验目的 |
| A | 室温下,用pH试纸测定浓度为0.1 mol·L-1NaClO溶液和0.1 mol·L-1 CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| B | 向盛有1 mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
| C | 向NaAlO2溶液中滴加饱和NaHCO3溶液,有白色沉淀产生 | 验证两者都发生了水解反应,且相互促进 |
| D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.t1时刻锌镀层已完全反应 |
B.锌镀层的厚度为 |
| C.反应放热也是影响OA段的反应速率的因素之一 |
| D.有原电池反应发生,正极的电极反应式为Zn - 2e → Zn2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| 实验操作 | 预期现象与结论 |
| 步骤1:取少量待测液放入试管中,滴加过量lmol/L氯化钡溶液。静置一段时间后,得到滤液A和固体B。 | |
| 步骤2:往固体B中加入蒸馏水洗涤沉淀,静置后弃去上层清液,向固体滴入2滴(或少量)品红,再 | 若品红褪色(或有气泡),则 |
| 步骤3: | 若 则 ; 否则 。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com