
(1)原NaOH溶液的质量分数为
(2)所得溶液中Cl-的物质的量为 mol
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)= 。
(1)10.7% (2)0.25 (3)3︰2
解析:本题是有关氯气性质的计算题。由物质的量浓度与质量分数的互换公式
w(NaOH)=![]() ×100%=
×100%=![]() ×100%=10.7%
×100%=10.7%
Cl2+H2![]() 2HCl
2HCl
Cl2+2NaOH===NaCl+NaClO+H2O
HCl+NaOH===NaCl+H2O
n(Cl-)=n(Na+)-n(ClO-)=![]() ×3.00 mol·L-1-0.050 0 mol=0.25 mol。与NaOH反应Cl2的物质的量为0.050 mol。Cl2与H2反应生成HCl的物质的量为:n(HCl)=0.25 mol-0.05 mol=0.20 mol,所用氯气和参加反应的氢气的物质的量之比
×3.00 mol·L-1-0.050 0 mol=0.25 mol。与NaOH反应Cl2的物质的量为0.050 mol。Cl2与H2反应生成HCl的物质的量为:n(HCl)=0.25 mol-0.05 mol=0.20 mol,所用氯气和参加反应的氢气的物质的量之比
![]() =
=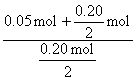 =
=![]()


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com