
| A. | V1=10V2 | B. | V1>10V2 | C. | V1<10V2 | D. | V2>10V1 |
分析 常温下,pH=9的氨水中c(OH-)=10-5 mol/L,pH=10的溶液中c(OH-)=10-4 mol/L,根据题意知,C1(NH3.H2O)V1=C2(NH3.H2O)V2,弱电解质溶液中,溶液浓度越大弱电解质电离程度越小,据此计算消耗氨水体积.
解答 解:常温下,pH=9的氨水中c(OH-)=10-5 mol/L,pH=10的溶液中c(OH-)=10-4 mol/L,根据题意知,C1(NH3.H2O)V1=C2(NH3.H2O)V2,弱电解质溶液中,溶液浓度越大弱电解质电离程度越小,所以$\frac{{V}_{1}}{{V}_{2}}$=$\frac{{c}_{2}}{{c}_{1}}$>10,所以得V1>10V2,故选B.
点评 本题以弱电解质的电离为载体考查酸碱混合溶液计算,为高频考点,明确弱电解质电离程度与其浓度关系是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
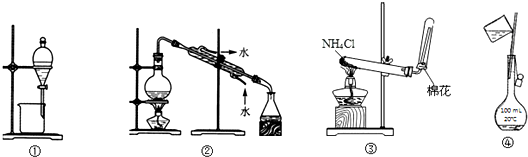
| A. | 选①可用于CC14提取碘水中的碘 | |
| B. | 选②可用于自来水制取蒸馏水 | |
| C. | 选③可用于实验室制取氨气 | |
| D. | 选④可用于配制100 mL 0.1 mol/L NaCl溶液(转移溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 LBr2所含溴原子的数目为2NA | |
| B. | 常温下,NO2与足量的水反应生成0.1molNO,转移的电子数为0.2NA | |
| C. | 1 mol 乙醇中含有的C-H键的数目为6NA | |
| D. | 1mol•L-1的NaClO溶液中含有的ClO-数目小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗铜与直流电源负极相连 | |
| B. | 相同时间内阳极质量变化与阴极质量变化可能不同 | |
| C. | 硫酸铜溶液浓度始终保持不变 | |
| D. | 杂质Ag以Ag2SO4的形式沉入电解槽形成“阳极泥” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解过程中阴极和阳极的质量始终保持不变 | |
| B. | 溶液中的Cu2+、H+和Na+都要移向阴极,但在阴极优先放电的离子是Cu2+ | |
| C. | 溶液中的Cl-在阳极上完全放电后,溶液中的SO${\;}_{4}^{2-}$接着在该极上放电生成O2 | |
| D. | 电解过程中阴极上始终有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若溶液中c(Cl-)=c(NH4+),则溶液一定呈中性 | |
| B. | 若c(Cl-)>c(NH4+)>c(H+)>c(OH-),则溶质一定为NH4Cl | |
| C. | 若c(OH-)>c(H+),则溶液中不可能存在:c(NH4+)>c(OH-)>c(Cl-)>c(H+) | |
| D. | 若溶质为NH4Cl、NH3•H2O,则一定存在:c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高锰酸钾溶液与乙二酸(草酸)反应:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O | |
| B. | 在NH4HSO4溶液中慢慢滴入等物质的量的NaOH溶液:NH4++OH-═NH3•H2O | |
| C. | VO2+与酸性高锰酸钾溶液反应:5VO2++MnO4-+H2O═5VO2++Mn2++2H+ | |
| D. | AgNO3溶液中加入过量氨水:Ag++NH3•H2O═AgOH↓+NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
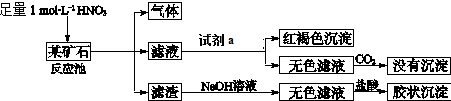
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com