
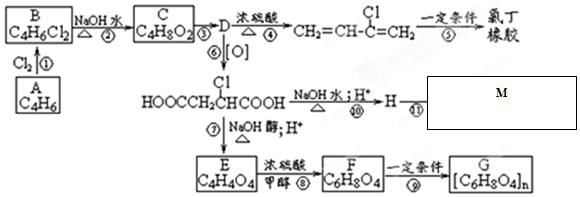

分析 A中只有两种氢原子且含有两个碳碳双键,结合A的分子式知A的结构简式为CH2=CHCH=CH2,A和氯气发生加成反应生成B,B和氢氧化钠的水溶液发生取代反应生成C,C反应生成D,D被氧化生成HOOCCH2CH(Cl)COOH,D发生消去反应生成CH2=CH-C(Cl)=CH2,则D的结构简式为HOCH2CH2CHClCH2OH,C的结构简式为HOCH2CH=CHCH2OH,B的结构简式为CH2ClCH=CHCH2Cl;
HOOCCH2CH(Cl)COOH和氢氧化钠的水溶液发生取代反应然后酸化生成M,M的结构简式为HOOCCH2CH(OH)COOH;
HOOCCH2CH(Cl)COOH和氢氧化钠的醇溶液发生消去反应生成E,E的结构简式为HOOCCH=CHCOOH,E和甲醇发生酯化反应生成F,F的结构简式为CH3OOCCH=CHCOOCH3,F在一定条件下发生加聚反应生成G,以此来解答.
解答 解:(1)通过以上分析知,上述反应中属于取代反应的是②⑧⑩,故答案为:②⑧⑩;
(2)通过以上分析知,C的结构简式HOCH2CH═CHCH2OH,故答案为:HOCH2CH═CHCH2OH;
(3)通过以上分析知,⑦的第 i步的化学反应方程式为HOOCCH2CHClCOOH+3NaOH→NaOOCCH═CHCOONa+NaCl+3H2O,
故答案为:HOOCCH2CHClCOOH+3NaOH→NaOOCCH═CHCOONa+NaCl+3H2O;
(4)M的结构简式为HOOCCH2CH(OH)COOH,M物质在浓硫酸存在下可分别生成一种含六元环、七元环、八元环的产物,M生成六元环产物的方程式为 ,
,
故答案为:;
(5)F的结构简式为CH3OOCCH=CHCOOCH3,F的同分异构体K,1molK能与2molNaHCO3反应则含有2mol-COOH,分子中无环状结构所以含有一个碳碳双键.根据碳链异构和官能团位置异构可知,含碳碳双键的烯烃有CH3CH═CHCH3、CH2═CHCH2CH3、CH2═C(CH3)2,2个-COOH采取定一移二的方法得到F的同分异构体K(不包含立体异构)有8+6+4=18种,故答案为:18;
(6)C生成E不能一步完成,而是通过③⑥⑦反应的原因是羟基在被氧化成羧基的同时,碳碳双键也会被氧化 (为了防止碳碳双键被氧化),
故答案为:羟基在被氧化成羧基的同时,碳碳双键也会被氧化 (为了防止碳碳双键被氧化).
点评 本题考查有机物的合成,为高频考点,把握合成流程中官能团的变化、碳链变化、有机反应为解答的关键,侧重分析与推断能力的考查,注意有机物性质的应用,题目难度不大.


科目:高中化学 来源: 题型:推断题
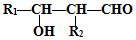
 ,G中含氧官能团的名称羟基、羧基.
,G中含氧官能团的名称羟基、羧基. $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$  +2H2O.
+2H2O.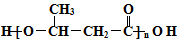 的路线图
的路线图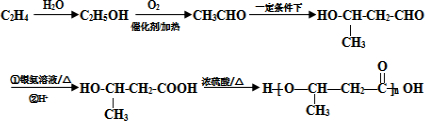 (提示:路线图的书写方法RCH=CH2
(提示:路线图的书写方法RCH=CH2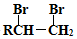 $→_{水/加热}^{NaOH}$
$→_{水/加热}^{NaOH}$ 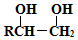 )
)查看答案和解析>>
科目:高中化学 来源: 题型:实验题
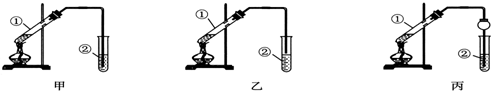
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4L Cl2中含有的分子数为6.02×1023个 | |
| B. | 0.1mol/LNa2CO3溶液加热后,溶液的pH减小 | |
| C. | 氢氧燃料电池工作时,H2在负极上失去电子 | |
| D. | 室温下,稀释0.1mol/LCH3COOH溶液,溶液的导电能力增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -332 | B. | -118 | C. | 350 | D. | 130 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
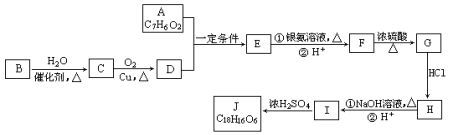
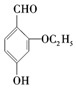 )是食品添加剂的增香原料.
)是食品添加剂的增香原料.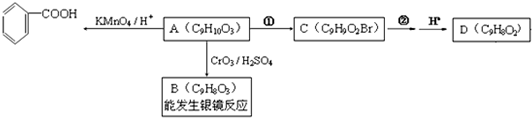
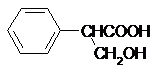 ,B
,B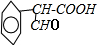 .
.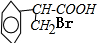 +H2O$→_{△}^{NaOH}$
+H2O$→_{△}^{NaOH}$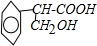 +HBr.
+HBr.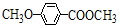 )是一种医药中间体.由茴香醛(
)是一种医药中间体.由茴香醛(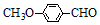 )合成E(其他原料自选),涉及的反应类型有(按反应顺序填写)氧化、酯化.
)合成E(其他原料自选),涉及的反应类型有(按反应顺序填写)氧化、酯化.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com