
���� �ٸ������ʵ����ʵ����뷴Ӧ�ȳ����ȣ��Ȼ�ѧ����ʽ����дҪ����������
��1mol�����������Ȼ������廯�������Ȼ�粒��壬�ų�176kJ��������ϻ�ѧ����ʽ��д�Ȼ�ѧ����ʽ��ע�����ʵľۼ�״̬�ͷ�Ӧ�ȵĵ�λ�����⣻
�۸���1mol CO��ԭ����Fe2O3��������Fe��s�����ų�8.2kJ �����������3molCO��Ӧ�ų�������������Ȼ�ѧ����ʽ��д������д��
����ϩ��C2H4��������������Ӧ����1mol H2O��l����CO2��g�����ų�705.5kJ���������������2molH2O�ų�������������Ȼ�ѧ����ʽ��д������д��
�ݸ��������������ʵ�������ϻ�ѧ����ʽ��Ӧ�����ʵ������㷴Ӧ�ų��������������Ȼ�ѧ����ʽ��д����д������ȼ�յ��Ȼ�ѧ����ʽ��ȼ������ָ1mol��������ȫȼ�������ȶ���������ų�����������֪1molҺ̬ˮ����ʱ��Ҫ����44kJ�����������Ȼ�ѧ����ʽ��˹���ɼ���õ���
��� �⣺��1g����ȼ������Һ̬ˮ���ų�142.9kJ����������2mol����ȼ������Һ̬ˮ���ų�������Ϊ142.9kJ��4=571.6kJ�����ԡ�H=-571.6kJ•mol-1�����Ȼ�ѧ����ʽΪ��2H2��g��+O2��g���T2H2O��l����H2=-571.6kJ•mol-1��H2��g��+$\frac{1}{2}$O2��g���TH2O��l����H2=-285.8 kJ•mol-1��
�ʴ�Ϊ��H2��g��+$\frac{1}{2}$O2��g���TH2O��l����H2=-285.8 kJ•mol-1��
��1mol�����������Ȼ������廯�������Ȼ�粒��壬�ų�176kJ���������Ȼ�ѧ����ʽΪ��NH3��g��+HCl��g���TNH4Cl��s����H=-176 kJ•mol-1��
�ʴ�Ϊ��NH3��g��+HCl��g���TNH4Cl��s����H=-176 kJ•mol-1��
��1mol CO��ԭ����Fe2O3��������Fe��s�����ų�8.2kJ ��������3molCO��Ӧ�ų�������Ϊ3��8.2kJ=24.6kJ�����Ȼ�ѧ����ʽ��3CO��g��+Fe2O3��s���T3CO2��g��+2Fe��s����H=-24.6 kJ•mol-1��
�ʴ�Ϊ��3CO��g��+Fe2O3��s���T3CO2��g��+2Fe��s����H=-24.6 kJ•mol-1��
����ϩ��C2H4��������������Ӧ����1mol H2O��l����CO2��g�����ų�705.5kJ������������2molH2O�ų�������Ϊ2��705.5kJ=1411kJ�����Ȼ�ѧ����ʽ�ǣ�C2H4��g��+3O2��g���T2CO2��g��+2H2O��l����H=-1411 kJ•mol-1��
�ʴ�Ϊ��C2H4��g��+3O2��g���T2CO2��g��+2H2O��l����H=-1411 kJ•mol-1��
�ݵ�10kg������ȫ��Ӧ���ʵ���$\frac{10000g}{58g/mol}$=$\frac{10000}{58}$mol����ȫȼ�ղ����ɶ�����̼��Һ̬ˮʱ���ų�����Ϊ5��105kJ��2mol������ȫ��Ӧ����=$\frac{\frac{5��1{0}^{5}kJ}{10000}}{58}$=5800kJ������ȼ�յ��Ȼ�ѧ����ʽ��2C4H10��g��+13O2��g��=8CO2��g��+10H2O��l����H=-5800kJ/mol��ȼ������ָ1mol��������ȫȼ�������ȶ���������ų��������������ȼ���ȡ�HΪ-2900kJ/mol��
��֪1molҺ̬ˮ����ʱ��Ҫ����44kJ������
��H2O��l��=H2O��g����H=44kJ/mol��
��2C4H10��g��+13O2��g��=8CO2��g��+10H2O��l����H=-5800kJ/mol��
���ݸ�˹���ɢ١�10+�ڵõ���2C4H10��g��+13O2��g��=8CO2��g��+10H2O��g����H=-5360kJ/mol��
����C4H10��g��+$\frac{13}{2}$O2��g���T4CO2��g��+5H2O��g����H=-2680KJ/mol��
�ʴ�Ϊ��2C4H10��g��+13O2��g��=8CO2��g��+10H2O��l����H=-5800kJ/mol��-2900��-2680��
���� ���⿼�����Ȼ�ѧ����ʽ����д������ע�����⣬ע�ⷴӦ�Ȼ�ѧ����ʽ��Ҫ��ע���ʾۼ�״̬����Ӧ���ķ�Ӧ�ȣ���Ŀ�Ѷ��еȣ�


 ����ȫ���ִʾ��ƪ��ϵ�д�
����ȫ���ִʾ��ƪ��ϵ�д� �����߿����ϵ�д�
�����߿����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | I2���� | |
| B�� | NaCl���������� | |
| C�� | �Ҵ�����ˮ | |
| D�� | NH4HCO3���ȷֽ�ʱ�����ŵ��̼�����ζ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
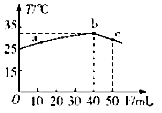 25��ʱ����ʢ��50mLpH=2��һԪ��HA��Һ�ľ��������м���pH=13��NaOH��Һ������NaOH��Һ�������V�������û����Һ���¶ȣ�T���Ĺ�ϵ��ͼ��ʾ������������ȷ���ǣ�������
25��ʱ����ʢ��50mLpH=2��һԪ��HA��Һ�ľ��������м���pH=13��NaOH��Һ������NaOH��Һ�������V�������û����Һ���¶ȣ�T���Ĺ�ϵ��ͼ��ʾ������������ȷ���ǣ�������| A�� | a��b�Ĺ����У���Һ��c��A-����c��HA��֮��ʼ�ղ��� | |
| B�� | c���ʾ���ǡ����ȫ��Ӧ | |
| C�� | 25��ʱ��HA�ĵ���ƽ�ⳣ��KaԼΪ1.43��10-3 | |
| D�� | ��Ũ�ȵ�NaOH��NaA �����Һ��һ�����ڹ�ϵ��c��Na+����c��A-����c��OH-������H+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
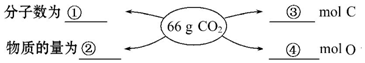
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
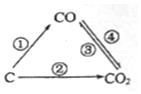 �������繤ҵ���õķ�չ���˿ڵľ�����ȫ����Դ���ż�������������Խ��Խ���ص����⣬��ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2������ȫ������ձ����ӣ�
�������繤ҵ���õķ�չ���˿ڵľ�����ȫ����Դ���ż�������������Խ��Խ���ص����⣬��ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2������ȫ������ձ����ӣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��1���������������������������Ҫԭ��֮һ���������������ж��ַ�����
��1���������������������������Ҫԭ��֮һ���������������ж��ַ������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | +1 | B�� | +2 | C�� | +3 | D�� | +5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com