
| A. | 100 g质量分数为98%的浓硫酸中所含有的氧原子数为4 NA | |
| B. | 足量的Fe与6.72 L Cl2反应转移的电子数为0.6 NA | |
| C. | 密闭容器中1 molN2与4 molH2反应生成的NH3分子数小于2NA | |
| D. | 3 g乙烷含有共用电子对为0.6 NA |
分析 A、浓硫酸中除了硫酸外,水也含氧原子;
B、氯气所处的状态不明确;
C、合成氨的反应为可逆反应;
D、求出乙烷的物质的量,然后根据乙烷中含7对共用电子对来分析.
解答 解:A、浓硫酸中除了硫酸外,水也含氧原子,故溶液中的氧原子的个数多于4NA个,故A错误;
B、氯气所处的状态不明确,故其物质的量无法计算,故B错误;
C、合成氨的反应为可逆反应,不能进行彻底,故生成的氨气分子个数小于2NA个,故C正确;
D、3g乙烷的物质的量为0.1mol,而乙烷中含7对共用电子对,故0.1mol乙烷中含0.7NA对共用电子对,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:实验题
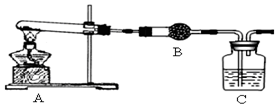
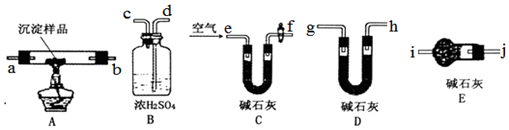
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+ NO3- I-SO42- | B. | MnO4- K+NO3-Na+ | ||
| C. | K+Al3+Cl-SO42- | D. | Mg2+SO32-Br-Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单阳离子的氧化性:Y>X | |
| B. | 气态氢化物的沸点:Z>M | |
| C. | X、Z与M不可能存在同一离子化合物中 | |
| D. | Y2Z的溶液:c(Y+):c(Z2-)>2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人体缺乏铁元素,可以补充硫酸亚铁,且多多益善 | |
| B. | 古代镀金(鎏金)工艺,利用了电镀原理 | |
| C. | 反复煮沸的水含有较多的亚硝酸盐,对人体有害 | |
| D. | 护肤品中含有的甘油具有美白作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和热的测定实验时,眼睛要注视温度计的刻度变化 | |
| B. | 萃取时,将混合物充分振荡后,需静置,待液体分层明显后才能分液 | |
| C. | 中和滴定实验时,为了使滴定终点的现象更加明显,可以滴加较多的指示剂 | |
| D. | 蒸馏时,温度计的读数刚达到某物质的沸点,不能立即收集馏出物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3、Na2SiO3 | B. | Na2CO3、SiO2 | C. | Na2SiO3 | D. | SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 阳离子 | NH4+、Mg2+ |
| 阴离子 | Cl-、CO32-、SO42-、NO3- |
| 序号 | 实验内容 | 实验现象 |
| Ⅰ | 向该溶液中加入足量Ba(OH)2溶液并加热 | 产生6.27g白色沉淀并放出1.12L有刺激性气味的气体 |
| Ⅱ | 将Ⅰ得到的沉淀中滴加足量的稀盐酸 | 有气体放出,沉淀变为2.33g |
| Ⅲ | 向Ⅱ反应后的滤液中滴加AgNO3溶液 | 有白色沉淀产生 |
| 阴离子 | NH4+ | Mg2+ | CO32- | SO42- |
| c/mol•L-1 | 0.5mol/L | × | 0.2mol/L | 0.1mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com