
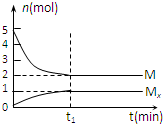
 E是非金属性最强的元素,M是E的气态氢化物,在一定体积的密闭容器中,气体M存在如下关系:aM(g)?bMx(g ),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )
E是非金属性最强的元素,M是E的气态氢化物,在一定体积的密闭容器中,气体M存在如下关系:aM(g)?bMx(g ),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )| A、该反应的化学方程式是2HF?(HF)2 |
| B、时刻,保持温度不变,再充入5molM,重新达到平衡时,将减小 |
| C、平衡时混合气体的平均摩尔质量是33.3g/mol |
| D、M的沸点比同主族下一周期元素的气态氢化物沸点低 |
. |
| M |
| m |
| n总 |
| c(Mx) |
| c(M) |
| 100g |
| 2mol+1mol |


科目:高中化学 来源: 题型:
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 8.3 | 9.6 |
| 沉淀完成 | 3.7 | 9.6 | 9.5 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯常温下是气体,为纯净物;聚乙烯常温下是固体,为混合物 |
| B、乙烯的化学性质比聚乙烯活泼 |
| C、取等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等 |
| D、取等物质的量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的物质的量分别相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
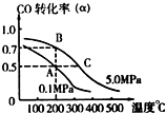 密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)=CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如下图所示.下列说法正确的是( )
密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)=CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如下图所示.下列说法正确的是( )| A、在 A、B两点对应的容器中,n(A)总:n(B)总=4:5 |
| B、在 A、C两点对应的容器中自反应开始到平衡状态所需的时间tA,<tC |
| C、设B、C两点的平衡常数分别为KB、KC,则KB<KC |
| D、在不改变反应物用量的情况下,降温、加压、将甲醇从混合体系中分离出来均可提高CO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 高温高压 |
| A、υ(H2)=0.3mol/(L?min) |
| B、υ(N2)=0.2mol/(L?min) |
| C、υ(NH3)=0.25mol/(L?min) |
| D、υ(H2)=0.4mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X、Y、Z、W的原子半径的大小关系为:W>Y>Z>X |
| B、在化合物Y2X2、Z2X4、X2W2中,分子所含的共用电子对数相等 |
| C、与元素Y、Z相比,元素W形成的简单氢化物最稳定,是因为其分子间存在氢键 |
| D、X、Y、Z、W四种元素可形成化学式为X7Y2ZW2的有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将2molSO3气体通入一密闭容器中,达平衡后吸收QkJ热量,则2SO3(g)?2SO2(g)+O2(g)△H=+Q KJ/mol |
| B、向含有0.4molFeBr2的溶液中通入0.2molCl2充分反应:2Fe2++Cl2=2Fe3++2Cl- |
| C、NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
| D、将FeCl3饱和溶液滴入沸水中制取Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3↓+3H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com