
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:
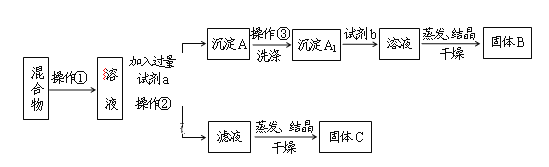
供选试剂:Na2SO4溶液、K2SO4溶液、K2CO3溶液、盐酸
(1)操作①的名称是___,操作②的名称是___。
(2)试剂a是___,固体B是___。(填化学式)
(3)生成沉淀A的离子反应方程式为:__加入试剂b所发生的化学反应方程式为:___。
(4)该方案能否达到实验目的:___。若不能,应如何改进(若能,此问不用回答)___。
(5)若要测定原混合物中KCl和BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是____的质量。
【答案】溶解 过滤 K2CO3 BaCl2 CO32-+Ba2+=BaCO3↓ BaCO3+2HCl=BaCl2+H2O+CO2↑ 不能 滤液中有过量的CO32-未除去,应加入稀盐酸除去 BaCl2(或:固体B或沉淀A1的质量)
【解析】
分离KCl和BaCl2两种固体混合物,可先溶于水,然后加入过量K2CO3使BaCl2转化为沉淀,过滤后沉淀加入盐酸可生成BaCl2溶液,经蒸发、结晶、干燥后可得固体BaCl2,操作②所得滤液为KCl和K2CO3的混合物,应加入过量盐酸可得KCl。
(1)将固体配成溶液,应加水溶解,操作②为固体和液体的分离,为过滤操作;
(2)固体溶解后加入过量K2CO3使BaCl2转化为沉淀,过滤后沉淀加入盐酸可生成BaCl2溶液,经蒸发、结晶、干燥后可得固体BaCl2;
(3)加入试剂a,K2CO3与BaCl2反应生成BaCO3沉淀,发生的离子方程式为CO32-+Ba2+=BaCO3↓,加入试剂b,BaCO3沉淀加入盐酸可生成BaCl2溶液,反应的化学方程式为:BaCO3+2HCl=BaCl2+H2O+CO2↑。
(4)滤液为KCl和K2CO3的混合物,⑥蒸发结晶前应加入适量稀盐酸,将过量的碳酸钾转化成氯化钾。
(5)固体溶解后加入过量K2CO3使BaCl2转化为碳酸钡沉淀,过滤后沉淀加入试剂b盐酸可将碳酸钡转化成BaCl2溶液,然后经蒸发、结晶、干燥后可得固体BaCl2,若要测定原混合物中KCl和BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是固体B或沉淀A1的质量,依据B为BaCl2计算得到质量分数,A1为碳酸钡,结合钡元素守恒计算氯化钡质量得到,故少还要获得的数据是:固体B或沉淀A1的质量。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下图是一种已投入生产的大型蓄电系统。电解质通过泵不断地在储罐和电池间循环;电池中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过;图中左边的电解质为Na2S2、Na2S4,右边电解质为NaBr3、NaBr。充、放电时发生的反应为:Na2S4+3NaBr![]() 2Na2S2+NaBr3,下列说法正确的是
2Na2S2+NaBr3,下列说法正确的是

A. 充电时b端为电源负极
B. 在放电过程中钠离子通过离子选择膜的流向为从右到左
C. 电池充电时,阴极的电极反应为S42-+2e-=2S22-
D. 以此蓄电池为电源电解精炼铜,当有0.1 mol e-转移吋时,阳极有3.2g铜溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮(N)、磷(P)、砷(As)等VA族元素的化合物在研究和生产中有重要用途,请回答下列问题:
(1)基态磷原子的电子排布图为________________,与砷原子同周期且含有的未成对电子数相同的元素有________种。
(2)(SCN)2分子中各元素的电负性由大到小的顺序为______________(用元素符号表述),分子中σ键和п键个数比为____________,(SCN)2能与Cu2+形成配合物,理由是_______________________________。
(3)CO2是N2O的等电子体,N2O中中心原子的杂化轨道类型为_______________。
(4)砷的一种氧化物俗称“砒霜”,我国科研人员研究发现砒霜对白血病有明显的治疗作用,其结构如图1所示,“砒霜”的化学式为___________,“砒霜”在一定条件下能转化成Na3AsO4,Na3AsO4中阴离子的空间构型为____________________。


图1 图2
(5)磷化硼是一种耐磨材料,其晶胞结构如图2所示,晶体中一个B原子周围距离最近的P原子有____个;若B、P原子半径分别为r1pm和r2pm,阿伏加德罗常数值为NA,晶体密度为d g/cm3,则磷化硼晶胞中原子的体积占晶胞体积的百分率为________ ×100% (用含d、r1、r2 的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 标准状况下,18g水的体积约为 22.4L
B. 25℃,1.01×105Pa,64gSO2中含有的氧原子数为3NA
C. NA个一氧化碳分子和 0.5mol 甲烷的质量比为 7∶4
D. 同温同压下,相同体积的气体单质含有的原子数目不一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 将饱和FeCl3溶液滴入沸水中制胶体,离子方程式:Fe3++3H2O![]() Fe(OH)3 ↓+3H+
Fe(OH)3 ↓+3H+
B. 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C. 一定条件下使化学平衡向正反应方向移动,反应物的转化率不一定增大
D. 升温时,若某可逆反应化学平衡常数K值变小,则表明该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组进行Fe(OH)3胶体的制备实验并检验其相关性质。
(1)若向装有饱和FeCl3溶液的烧杯中分别滴入下列物质中,能形成胶体的是_______(填序号)。
a.冷水 b.沸水 c.NaOH浓溶液 d.NaCl浓溶液
(2)写出制备Fe(OH)3胶体的化学方程式:_____________________
(3)用激光笔照射装有Fe(OH)3胶体的烧杯,能在侧面看到一条_________,这种现象称为丁达尔效应
(4)Fe(OH)3胶体与Fe(OH)3沉淀的本质区别是________(填序号)。
a.分散质粒子大小不同 b.颜色不同 c.后者不稳定
(5)若向制得的胶体中再加入稀HCl,红褐色分散系会被破坏,变为黄色溶液,写出相关离子方程式 ____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数数值,下列叙述中正确的是( )
A.1.8 g的NH4+ 离子中含有的电子数为0.1NA
B.1mol Na2O2 固体中含离子总数为4NA
C.标准状况下,2.24L CCl4所含的共价键数为O.4NA
D.常温常压下,92g NO2和N2O4的混合气体含有的原子数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pOH=-lgc(OH-)。室温下,将稀盐酸滴加到某一元碱(BOH)溶液中,测得混合溶液的pOH与离子浓度的变化关系如图所示。下列叙述错误的是

A. BOH属于弱碱
B. BOH的电离常数K=1×10-4.8
C. P点所示的溶液中:c(Cl-)>c(B+)
D. N点所示的溶液中:c(H+)=c(Cl-)+c(OH-)-c(BOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述正确的是
A.3g3He含的中子数为2NA
B.28g乙烯(C2H4)和环丁烷(C4H8)的混合气体所含碳原子数为2NA
C.标准状况下22.4LCl2与NaOH溶液完全反应,转移的电子数为2NA
D.1L0.4mol/L盐酸与0.1molMnO2共热后,生成Cl2的分子数为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com