
分析 (1)智利硝石其主要成分是NaNO3,还含少量NaIO3等可溶盐和不溶物,从智利硝石分离出NaNO3,的实验步骤为溶解过滤除去不溶性杂质,通过蒸发浓缩,冷却结晶,过滤洗涤,干燥分离得到较纯净的硝酸钠;
(2)用NaNO3和浓硫酸反应可以生成硝酸和硫酸氢钠,硝酸具有氢氧化性能氧化橡胶;
(3)现在工业上制NaNO3主要采用化学合成的方法,涉及的工业制备有氮气和氢气合成氨,氨气催化氧化生成一氧化氮和水,一氧化氮已化为二氧化氮,二氧化氮溶于水生成硝酸,为充分吸收通入水中的氧气和一氧化氮体积比为3:4.
解答 解:(1)智利硝石其主要成分是NaNO3,还含少量NaIO3等可溶盐和不溶物,从智利硝石分离出NaNO3,的实验步骤为溶解过滤除去不溶性杂质,通过蒸发浓缩,冷却结晶,过滤洗涤,干燥分离得到较纯净的硝酸钠,
故答案为:过滤、蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(2)用NaNO3和浓硫酸反应可以生成硝酸和硫酸氢钠,反应的化学方程式为:NaNO3+H2SO4=NaHSO4+2HNO3↑,硝酸具有氢氧化性能氧化橡胶,热的硝酸会腐蚀橡胶,制取装置中应该用磨砂接口代替胶管和胶塞,
故答案为:NaNO3+H2SO4$\frac{\underline{\;微热\;}}{\;}$NaHSO4+2HNO3↑;磨砂接口;
(3)现在工业上制NaNO3主要采用化学合成的方法,涉及的工业制备有氮气和氢气合成氨,氨气催化氧化生成一氧化氮和水,一氧化氮氧化为二氧化氮,二氧化氮溶于水生成硝酸,为充分吸收通入水中的氧气和一氧化氮体积比为3:4,工业制硝酸的化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O、4NO+3O2+2H2O=4HNO3;
故答案为:合成氨;氯碱工业;4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;4NO+3O2+2H2O=4HNO3.
点评 本题考查了氮及其化合物性质的分析应用,题目难度中等,涉及化学实验基本操作、物质分离提纯、氧化还原反应的实质理解应用,掌握基础知识为解题关键.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ②③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 同主族元素随原子序数递增,元素原子的得电子能力逐渐增强 | |
| B. | 同主族元素随原子序数递增,单质氧化能力逐渐增强 | |
| C. | 同主族元素原子最外层电子数都相同 | |
| D. | 同主族元素的原子半径,随原子序数增大而逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 逸出ClO2使生成物浓度降低 | B. | 酸使HClO2的分解加速 | ||
| C. | 溶液中的H+起催化作用 | D. | 溶液中的Cl-起催化作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 CO2
CO2

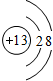 Cl
Cl .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
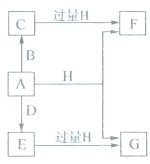
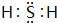 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com