
乙二酸(H2C2O4)是一种重要的化工产品,可以使酸性高锰酸钾溶液褪色,其制备工艺流程如下:
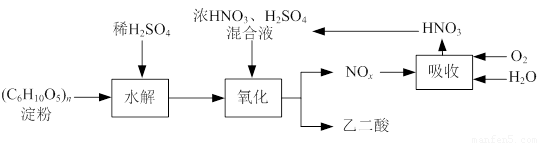
氧化时控制反应液温度为55~60℃,边搅拌边缓慢滴加浓HNO3、H2SO4混合液,可发生下列反应:
C6H12O6+18HNO3→3H2C2O4+18NO2↑+12H2O
C6H12O6+6HNO3→3H2C2O4+6NO↑+6H2O
⑴检验氧化后的溶液中是否仍含有葡萄糖的实验方案为 。
⑵氧化时控制反应液温度为55~60℃的原因是 。
⑶若水解时淀粉利用率为80%,氧化时葡萄糖的利用率为80%,结晶时有10%的乙二酸遗留在溶液中。则30 kg淀粉可生产乙二酸的质量为 。
⑷生产中产生的NOx用氧气和水吸收后产生硝酸循环利用,若尾气NOx中n(NO2)︰n(NO)=2︰1,且NOx的吸收转化率为90%。计算:理论上,每生产9 kg乙二酸至少需要补充质量分数为63%的硝酸溶液多少千克。(写出计算过程)
⑴取氧化后所得溶液,加入过量NaOH溶液,再向其中加入新制Cu(OH)2,加热。若有砖红色沉淀产生,说明含有葡萄糖。 (2分)
⑵若温度过低反应过慢,若温度过高硝酸会分解(或挥发) (2分)
⑶28.8 kg (2分) ⑷3.6kg(6分)
【解析】
试题分析:(1)葡萄糖中含有醛基,据此可以鉴别和检验,即取氧化后所得溶液,加入过量NaOH溶液,再向其中加入新制Cu(OH)2,加热。若有砖红色沉淀产生,说明含有葡萄糖。
(2)由于温度过低反应过慢,而温度过高硝酸会分解(或挥发),所以氧化时应该控制反应液温度为55~60℃。
(3)根据反应的方程式可知,(C6H10O5)n~n C6H12O6~3nH2C2O4
所以根据题意可知30 kg淀粉可生产乙二酸的质量为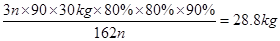 。
。
(4)设每产生9 kg H2C2O4反应中产生NO2的物质的量为x,产生NO的物质的量为y
C6H12O6+18HNO3→3H2C2O4+18NO2↑+12H2O
18 3 18
x x/6 x
C6H12O6+6HNO3→3H2C2O4+6NO↑+6H2O
6 3 6
y y/2 y
x=2y
(x/6+y/2)×90 g·mol-1=9×103 g
x="240" mol y="120" mol
需补充的硝酸m(HNO3)="360" mol×(1-90%)×63 g·mol-1÷63%
="3600" g="3.6" kg
考点:考查葡萄糖的检验、反应条件的控制、产物的计算
点评:该题是中等难度的试题,试题基础性强,难易适中。在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练。旨在培养学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力以及规范答题能力。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
H![]() CaC2O4↓(白色)+2H2O
CaC2O4↓(白色)+2H2O
为探究乙二酸晶体(H

回答下列问题:
(1)乙二酸晶体(H
(2)a处试剂的名称是________________,反应一段时间后a处的现象为____________。
(3)足量澄清石灰水的作用是________________。
装置乙不能缺少,理由是_________________。
(4)丙中b处逸出的气体可能是________________。检验的方法是_______________(用化学方程式表示)。
(5)简述检查上述装置气密性的方法:__________________。
(6)乙二酸还可能具有的性质是_________________。(填序号)
A.能与银氨溶液发生银镜反应 B.能使酸性KMnO4溶液褪色
C.能与Na2CO3反应生成CO2 D.能使蓝墨水褪色
查看答案和解析>>
科目:高中化学 来源:2011届辽宁省沈阳二中高三第五次模拟考试(理综)化学部分 题型:实验题
某研究性学习小组通过实验来探究乙二酸(又名草酸)受热分解的产物(水除外),他们设计的实验装置如下图所示: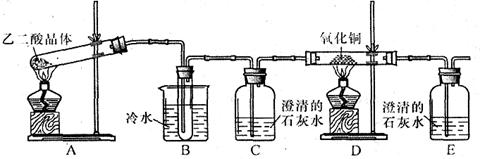
查阅资料可知:乙二酸晶体(H2C2O4·2H2O)熔点100.1 ℃,草酸钙是难溶于水的白色固体;Cu2O能溶于稀硫酸,立即发生歧化反应生成Cu2+和Cu。
(1)实验过程中观察到C、E装置中的溶液均变浑浊,且D装置中黑色粉末变为红色,写出A中发生反应的化学方程式: ;
(2)装置B的作用是 ;指出上述装置中的不足之处: 。
(3)实验结束后向装置B的试管中加入少量酸性重铬酸钾溶液,可以观察到的实验现象是溶液由橙色变为绿色(Cr3+),反应的离子方程式为 。
(4)有人认为D装置中得到的红色固体可能是Cu,也可能是Cu和Cu2O的混合物。实验小组进一步探究:
①取少量红色固体加入到盛稀硫酸的试管中,充分振荡,溶液变为蓝色,试管底部仍有红色固体,由此可以得出的结论是 。
②取该红色固体与足量的稀硝酸反应,写出反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年湖北省高三5月模拟考试(理综)化学部分 题型:实验题
某研究性学习小组通过实验来探究乙二酸(又名草酸)受热分解的产物,他们设计的实验装置如下图所示:
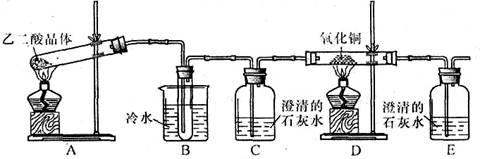
查阅资料可知:乙二酸晶体(H2C2O4·2H2O)熔点100.1 ℃,草酸钙是难溶于水的白色固体;Cu2O能溶于稀硫酸,立即发生歧化反应生成Cu2+和Cu。
(1)实验过程中观察到C、E装置中的溶液均变浑浊,且D装置中黑色粉末变为红色,写出A中发生反应的化学方程式: ;
(2)装置B的作用是 ;上述装置中有两处需要改进(假设洗气装置每次吸收气体均完全),改进方法是 ; 。
(3)实验结束后向装置B的试管中加入NaHCO3溶液,产生大量无色气体,由此可以证明两种物质的酸性强弱顺序是 。
(4)有人认为D装置中得到的红色固体可能是Cu,也可能是Cu和Cu2O的混合物。实验小组进一步探究:[来源:Zxxk.Com]
①取少量红色固体加入到盛稀硫酸的试管中,充分振荡,溶液变为蓝色,试管底部仍有红色固体,由此可以得出的结论是 。
②取6.8g红色固体与足量的稀硝酸反应,收集到标准状况下的NO气体1.12L。则红色固体中含单质铜的质量分数是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com