
| 实验次数编号 | 盐酸溶液体积V(mL) | 氢氧化钠溶液体积V(mL) |
| 1 | 19.90 | 10.00 |
| 2 | 20.10 | 10.00 |
| 3 | 22.00 | 10.00 |
| 4 | 20.00 | 10.00 |
分析 (1)根据操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作选取实验仪器;
(2)①用碱式滴定管量取烧碱溶液于锥形瓶中;
②根据滴定时,两眼注视锥形瓶中溶液颜色的变化;溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(3)先分析数据的有效性,求出消耗盐酸的平均体积,然后根据关系式NaOH~HCl求出氢氧化钠的物质的量浓度,再计算烧碱样品的纯度;
(4)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断操作误差;根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(待测)的影响,以此判断操作误差.
解答 解:(1)操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水),冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,需要的仪器是天平、药匙、烧杯、量筒、玻璃棒、250mL容量瓶、胶头滴管;
故答案为:250mL容量瓶、胶头滴管;
(2)①烧碱溶液需要用碱式滴定管量取,用锥形瓶盛放待测液;
故答案为:碱式;
②滴定时,两眼注视锥形瓶中溶液颜色的变化,以便准确判断终点的到达;滴定时,当滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不恢复;
故答案为:锥形瓶内溶液颜色的变化;溶液由红色变为无色,且半分钟内不恢复;
(3)4次消耗盐酸体积分别为:19.90mL、20.10mL、22.00mL(舍去)、20.00mL,三消耗盐酸的平均体积为:20.00mL,
NaOH~HCl
1 1
c(NaOH)×0.01L 0.2010mol•L-1×0.02L
解得:c(NaOH)=0.4020mol•L-1,
即10.00mL待测溶液含有m(NaOH)=n•M=0.00402mol×40g/mol=0.1608g,所以250mL待测溶液含有m(NaOH)=0.1608g×$\frac{250}{10}$=0.402g,烧碱的纯度ω(烧碱)=$\frac{0.402g}{4.1g}$×100%=98.05%,
故答案为:0.4020mol•L-1;98.05%;
(4)①碱式滴定管用蒸馏水洗净后没有用待测液润洗,待测液被稀释,待测液的物质的量偏小,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏小,故①正确;
②终点读数时俯视(滴定前读数准确),造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏小,故②错误;
③锥形瓶用蒸馏水洗净后没有用待测液润洗,对V(标准)无影响,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)无影响,故③错误;
④酸式滴定管尖端气泡没有排除,滴定后消失,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏大,故④错误;
⑤酸式滴定管用蒸馏水洗净后没有用标准液润洗,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏大,故⑤错误;
⑥振荡时锥形瓶中液滴飞溅出来,待测液的物质的量偏小,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏小,故⑥正确;
若把待测烧碱溶液放在滴定管中:
①碱式滴定管用蒸馏水洗净后没有用待测液润洗,待测液被稀释,浓度偏小,造成V(待测)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏小,故①正确;
②终点读数时俯视(滴定前读数准确),造成V(待测)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏大,故②错误;
③锥形瓶用蒸馏水洗净后没有用标准液润洗,对V(待测)无影响,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)无影响,故③错误;
④碱式滴定管尖端气泡没有排除,滴定后消失,造成V(待测)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏小,故④正确;
⑤酸式滴定管用蒸馏水洗净后没有用标准液润洗,溶液被稀释,浓度偏小,标准液的物质的小,造成V(待测)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏大,故⑤错误;
⑥振荡时锥形瓶中液滴飞溅出来,标准液的物质的量偏小,造成V(待测)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏大,故⑥错误;
故选:①②⑥;①④.
点评 本题考查酸碱中和滴定实验,题目难度中等,把握实验的原理、步骤、方法以及注意事项和误差分析是解题的关键,注意反向滴定误差分析.


 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COONa | B. | CH3COOH和CH3COONa | ||
| C. | CH3COONa和NaOH | D. | CH3COOH和NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
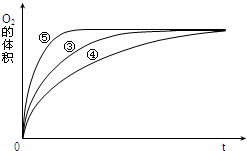 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 |
| 3.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 1.5mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
| 3.0mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
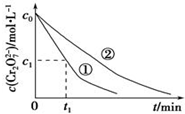 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 |
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R气态氢化物化学式为H2R | |
| B. | R一定是Ⅵ族元素 | |
| C. | R的气态氢化物比同周期其他元素气态氢化物稳定 | |
| D. | R一定是第四周期元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com