
【题目】复旦大学研发的一种新型水锂电池,一极采用复合膜包裹的金属锂,另一极采用锰酸锂(LiMn2O4),以0.5mol·L-1Li2SO4水溶液作电解质,安全性能和成本较现有的锂离子电池都具有明显的优势。下列有关该电池的说法不正确的是( )

A.电极a是负极,电极b是正极
B.工作时电池的总反应为:LiMn2O4+Li=Li2Mn2O4
C.放电时,溶液中Li+从a向b迁移
D.电池放电时的阳极反应式为:Li2Mn2O4e-=LiMn2O4+Li+
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】异丁烯![]() 是一种重要的化工原料,可由异丁烷
是一种重要的化工原料,可由异丁烷![]() 直接催化脱氢制备:
直接催化脱氢制备:
(1)已知:![]()
![]()
写出由异丁烷![]() 催化脱氢制备异丁烯
催化脱氢制备异丁烯![]() 的热化学方程式。_________。
的热化学方程式。_________。
(2)一定条件下,以异丁烷为原料催化脱氢生产异丁烯。温度、压强的改变对异丁烷平衡转化率的影响如图所示。

①判断![]() 、
、![]() 的大小关系:
的大小关系:![]() _____________
_____________![]() (填“>”或“<”);能使单位时间内异丁烯的产量提高,又能使异丁烷平衡产率提高,应采取的措施是____________(填标号)。
(填“>”或“<”);能使单位时间内异丁烯的产量提高,又能使异丁烷平衡产率提高,应采取的措施是____________(填标号)。
a.升高温度 b.降低温度 c.增大压强 d.降低压强 e.使用催化剂
②平衡常数的表达式中的平衡浓度可以用平衡时各气体的分压代替(气体a的分压=气体a的物质的量分数×总压强,即![]() (总)。求图中的A点状态下的异丁烷脱氢反应的平衡常数
(总)。求图中的A点状态下的异丁烷脱氢反应的平衡常数![]() _____________(保留两位有效数字)。
_____________(保留两位有效数字)。
(3)温度对催化剂的活性和目标产物的选择性都有一定的影响。下表是以![]() 为催化剂,在反应时间相同时,测得的不同温度下的数据。
为催化剂,在反应时间相同时,测得的不同温度下的数据。
温度/℃ | 550 | 570 | 590 | 610 | 630 |
异丁烷转化率/% | 13.8 | 24.5 | 25.6 | 30.0 | 33.3 |
异丁烯选择性/% | 93.9 | 88.3 | 95.0 | 80.4 | 71.2 |
异丁烯的产率/% | 12.9 | 21.6 | w | 24.1 | 23.7 |
已知①选择性![]() ;②异丁烷高温下裂解生成短碳链烃类化合物
;②异丁烷高温下裂解生成短碳链烃类化合物
①590℃时异丁烯的产率![]() _____________×100%。
_____________×100%。
②在590℃之前异丁烯的产率随温度升高而增大的原因可能是____________、_____________。
③590℃之后,异丁烯产率降低的主要原因可能是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在50 mL 4 mol·L-1的氢氧化钠溶液中,通入一定量的硫化氢,反应完毕,在常温减压条件下,用氮气把溶液吹干,得到白色固体7.92 g,通过计算确定白色固体的组成及各组分的质量。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g) + 4H2(g)![]() CH4(g) + 2H2O(g),若温度从300℃升至400℃,反应重新达到平衡时,H2的体积分数增加。下列关于该过程的判断正确的是
CH4(g) + 2H2O(g),若温度从300℃升至400℃,反应重新达到平衡时,H2的体积分数增加。下列关于该过程的判断正确的是
A. 该反应的ΔH < 0 B. 化学平衡常数K增大
C. CO2的转化率增加 D. 正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图:
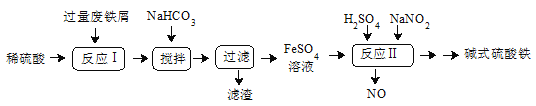
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.0 | 5.9 | 3.7 |
完全沉淀 | 3.5 | 8.4 | 4.7 |
请回答下列问题:
(1)该工艺中“搅拌”的作用是__,写出反应I中发生氧化还原反应的离子方程式__。
(2) “滤渣”的主要成分是__(填化学式),加入适量NaHCO3的目的是调节pH在__范围内。
(3)反应Ⅱ中加入NaNO2的离子方程式为__,在实际生产中,可以同时通入O2以减少NaNO2的用量,若参与反应的O2有5.6L(标况),则理论上相当于节约NaNO2(Mr=69)用量__g。
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解为Fe2(OH)![]() 聚合离子,该水解反应的离子方程式为__。
聚合离子,该水解反应的离子方程式为__。
(5)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:取25.00mL溶液,稀释到250mL,准确量取20.00mL于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用0.01000mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。已知:2Fe3++2I-==2Fe2++I2、2![]() +I2==2I-+
+I2==2I-+![]()
则溶液中铁元素的总含量为__g·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g)△H=+57kJmol﹣1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是
2NO2(g)△H=+57kJmol﹣1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是

A.a、c两点气体的平均相对分子质量:a>c
B.a、c两点气体的颜色:a深,c浅
C.由状态b到状态a,可以用加热的方法
D.a、c两点的反应速率:a>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳族元素的单质及其化合物在生产、生活中是一类重要物质。请回答下列问题
(1)碳原子核外有__种不同运动状态的电子,第一电离能介于硼和碳之间的元素的名称为__,碳族元素外围电子排布的通式为__。
(2)青蒿素(C15H22O5)的结构如图所示,图中数字标识的五个碳原子的杂化轨道类型为__,组成青蒿素的三种元素电负性由大到小排序是__。

(3)青蒿素分子中,氧元素的成键方式有___;从青蒿中提取青蒿素的最佳溶剂是___。
a.乙醇 b.乙醚 c.水
(4)SnO2是一种重要的半导体传感器材料,用来制备灵敏度高的气敏传感器,SnO2与熔融NaOH反应生成Na2SnO3,Na2SnO3中阴离子空间构型为__。
(5)第三代太阳能电池利用有机金属卤化物碘化铅甲胺(CH3NH3PbI3,相对分子质量为Mr)半导体作为吸光材料,CH3NH3PbI3具有钙钛矿(AMX3)的立方结构,其晶胞如图所示。AMX3晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则X处于__位置。CH3NH3PbI3晶体的晶胞参数为anm,其晶体密度为dg·cm-3,则阿伏加德罗常数的值NA的计算表达式为__。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳”既是时尚,也是环保要求。“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂今后联合生产等都是很好的“低碳”生产方式。下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺:

请回答下列问题:
(1)工艺操作①、②分别为____________、____________。
(2)工业合成氨的化学方程式为:__________。
(3)写出生成“产品”的离子方程式:________。
(4)在实验室中检验合成氨厂排出的废气中是否含有氨气的方法是______________。
(5)副产品的化学式为________________。该联合生产工艺中可以循环使用的物质是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:
①C2H2(g)+![]() O2(g)
O2(g)![]() 2CO2(g)+H2O(l) ΔH1=-1 301.0 kJ·mol-1
2CO2(g)+H2O(l) ΔH1=-1 301.0 kJ·mol-1
②C(s)+O2(g)![]() CO2(g) ΔH2=-393.5 kJ·mol-1
CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH3=-285.8 kJ·mol-1
H2O(l) ΔH3=-285.8 kJ·mol-1
则反应④2C(s)+H2(g)![]() C2H2(g)的ΔH为( )
C2H2(g)的ΔH为( )
A. -228.2 kJ·mol-1B. +228.2 kJ·mol-1
C. +1301.0 kJ·mol-1D. +621.7 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com