
 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:分析 (1)①图象分析可知随氢离子浓度增大,铬酸根离子转化为重铬酸根离子;A点c(Cr2O72-)=0.25mol/L,c(H+)=10-7mol/L,c(CrO42-)=0.5mol/L,依据平衡常数概念计算,K=$\frac{c(C{r}_{2}{O}_{7}^{2-})}{{c}^{2}({H}^{+}){c}^{2}(C{r}_{2}{O}_{4}^{2-})}$;
②溶液酸性增大,平衡2CrO42-+2H+?Cr2O72-+H2O正向进行,CrO42-的平衡转化率增大;A点Cr2O72-的浓度为0.25mol/L,则消耗的CrO42-的浓度为0.5mol/L,则溶液中的c(CrO42-)=1.0mol/L-0.25mol/L×2=0.5mol/L,H+浓度为1×10-7mol/L,计算反应的平衡常数;
③升高温度,溶液中CrO42-的平衡转化率减小,平衡逆向移动,升高温度平衡向吸热方向移动,据此判断.
(2)当溶液中Cl-完全沉淀时,即c(Cl-)=1.0×10-5mol/L,依据Ksp(AgCl)=2.0×10-10,计算得到c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$,依据计算得到的银离子浓度和溶度积常数计算此时溶液中c(CrO42-)=$\frac{Ksp(A{g}_{2}Cr{O}_{4})}{{c}^{2}(A{g}^{+})}$.
解答 解:(1))①随着H+浓度的增大,CrO42-转化为Cr2O72-的离子反应式为:2CrO42-+2H+?Cr2O72-+H2O,
故答案为:2CrO42-+2H+?Cr2O72-+H2O;
②溶液酸性增大,平衡2CrO42-+2H+?Cr2O72-+H2O正向进行,CrO42-的平衡转化率增大;A点Cr2O72-的浓度为0.25mol/L,则消耗的CrO42-的浓度为0.5mol/L,则溶液中的c(CrO42-)=1.0mol/L-0.25mol/L×2=0.5mol/L,H+浓度为1×10-7mol/L,此时该转化反应的平衡常数为 K=$\frac{c(C{r}_{2}{O}_{7}^{2-})}{{c}^{2}({H}^{+}){c}^{2}(C{r}_{2}{O}_{4}^{2-})}$=$\frac{0.25}{0.{5}^{2}×(1{0}^{-7})^{2}}$=1.0×1014,
故答案为:增大;1.0×1014;
③升高温度,溶液中CrO42-的平衡转化率减小,平衡逆向移动,说明正方向放热,则该反应的△H<0,
故答案为:小于.
(2)当溶液中Cl-完全沉淀时,即c(Cl-)=1.0×10-5mol/L,依据Ksp(AgCl)=2.0×10-10,计算得到c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$=$\frac{2.0×1{0}^{-10}}{1.0×1{0}^{-5}}$=2.0×10-5mol/L
此时溶液中c(CrO42-)=$\frac{Ksp(A{g}_{2}Cr{O}_{4})}{{c}^{2}(A{g}^{+})}$=$\frac{2.0×1{0}^{-12}}{(2.0×1{0}^{-5})^{2}}$=5.0×10-3mol/L,
故答案为:2.0×10-5 ;5.0×10-3.
点评 本题考查化学反应原理的分析与探究、化学平衡常数、溶度积常数的计算的知识,注意平衡常数的理解应用,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
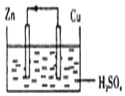
| A. | 构成原电池的正极和负极的材料必须是两种金属 | |
| B. | 在该原电池中,铜作负极 | |
| C. | 电子通过硫酸溶液由锌流向铜,在铜电极上被氢离子得到而放出氢气 | |
| D. | 铜锌原电池工作时,若有13g锌溶解,则电路中就有0.4mol电子通过 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:Y<Z<W | |
| B. | X和Y两种元素可形成多种二元化合物 | |
| C. | X、Z和W三种元素形成的化合物属于强电解质 | |
| D. | 元素的非金属性:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
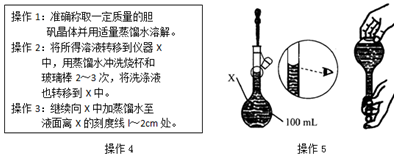
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢是一种清洁的可再生能源.
氢是一种清洁的可再生能源.| 化学键 | H-H(g) | H-O(g) | O≡O(g) |
| 键能(KJ/mol) | 436 | 463 | 496 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a=b,则m+n<14 | |
| B. | 若a=b,则HX一定是弱酸 | |
| C. | 反应后溶液中一定存在c(Na+)>c(X-)>c(OH-)>c(H+) | |
| D. | 若a=2b,则反应后溶液中一定存在2c(OH-)=c(HX)+2c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
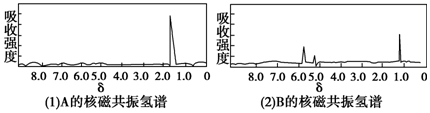
| A. | A是C3H8;B是C6H6 | B. | A是C4H10;B是C6H6 | ||
| C. | A是C3H6;B是C3H6 | D. | A是C3H6;B是C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质(杂质) | 试剂 | |
| A | CH4(SO2) | 酸性高锰酸钾溶液 |
| B | 氧化铁(氧化铝) | KOH溶液 |
| C | 氯化氢(氯气) | CCl4 |
| D | 溴苯(乙醇) | 苯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属元素锂、钠、钾、铷、铯,随着核电荷数的增加其单质的熔沸点逐渐降低 | |
| B. | 卤族元素氟、氯、溴、碘,随着核电荷数的增加其单质的熔沸点逐渐升高 | |
| C. | NaOH、KOH、Mg(OH)2的碱性依次减弱 | |
| D. | 在周期表中金属与非金属的分界处可以找到半导体材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com