
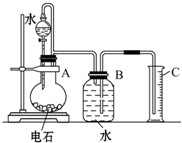
 某同学设计了如图所示的实验装置来粗略地测定电石中碳化钙的质量分数.
某同学设计了如图所示的实验装置来粗略地测定电石中碳化钙的质量分数.| 0.29V |
| W |
| 0.29V |
| W |
| 0.29V |
| W |
| 0.29V |
| W |


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
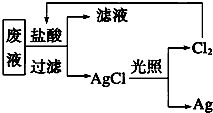 国务院强调,“南水北调”工程必须坚持节水、治污和生态环境保护与工程建设相协调,以水资源合理配置为主线,把节水、治污、生态环境保护与调水作为一个完整的系统来分析的原则.在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中,含有大量的Mg2+、Al3+、Cu2+、Ag+.试分析回答下列问题:
国务院强调,“南水北调”工程必须坚持节水、治污和生态环境保护与工程建设相协调,以水资源合理配置为主线,把节水、治污、生态环境保护与调水作为一个完整的系统来分析的原则.在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中,含有大量的Mg2+、Al3+、Cu2+、Ag+.试分析回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
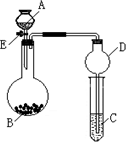 某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
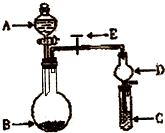 (2010?临沂一模)化学实验中一套装置往往可以完成多个实验,A某同学设计了如图所示装置(夹持仪器省略)进行系列实验.请回答:
(2010?临沂一模)化学实验中一套装置往往可以完成多个实验,A某同学设计了如图所示装置(夹持仪器省略)进行系列实验.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 | 10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com